- 最新进展
- 产品信息
一、RAS 基因的发现
在现代医学发展的历程中,19 世纪末巴斯德等科学家在抗感染领域取得了巨大成功。随后一系列关于肿瘤的观察和研究,让人们曾一度认为肿瘤是由病毒所致的传染病。1910 年,Peyton Rous 发现了第一个肿瘤病毒劳氏肉瘤病毒(RSV),此后多种致瘤病毒相继被发现,人们也因此深信肿瘤是病毒导致的疾病。
直到 1974 年,J.Michael Bishop 和 Harold Varmus 通过 DNA 探针发现,未被感染的正常细胞中也存在与 RSV 病毒中相同的肿瘤基因 src。这一发现揭示了肿瘤基因其实早已存在于宿主基因组中,病毒只是从宿主细胞获取并改造了这些基因片段。这一突破打开了现代肿瘤生物学的大门,Bishop 和 Varmus 也因此荣获 1989 年的诺贝尔奖。
在此之前,Harvey 和 Kirsten 等人在 20 世纪 60 年代分别发现了老鼠肿瘤基因 HRAS 和 KRAS。1982 年,Weinberg 等实验室在人类膀胱癌细胞中发现了 HRAS,使 RAS 成为第一个被发现的人类肿瘤基因。如今,RAS 基因已被证实是肿瘤中最常见的突变基因之一,约 30% 的肿瘤携带 RAS 变异,若考虑其调控因子及信号通路上下游的变异,几乎覆盖所有肿瘤,每年导致超百万患者死亡,堪称 “肿瘤基因之王”。
二、KRAS 基因
(一)基因与蛋白的基本特征
KRAS 基因全称为 Kirsten 大鼠肉瘤病毒癌基因同源物,编码的蛋白是一种小 GTP 酶,属于 RAS 超蛋白家族。在人类基因组中,有两个 KRAS 基因,其中 KRAS1 是无功能的 “假基因”,位于 6 号染色体短臂;KRAS2 是具有生物学活性的 “真基因”,位于 12 号染色体短臂,通常研究的 KRAS 基因和蛋白即指 KRAS2 及其产物。
KRAS 蛋白有两种变体 KRAS4A 和 KRAS4B,由第 4 号外显子在 RNA 剪接过程中的不同方式产生,其中 KRAS4B 的表达量约为 KRAS4A 的 5 倍。KRAS 蛋白由 188 个氨基酸组成,分子量为 21.6KD,是具有 GTPase 酶活性的鸟嘌呤核苷结合蛋白,通过法呢酰基修饰定位在细胞膜内侧。
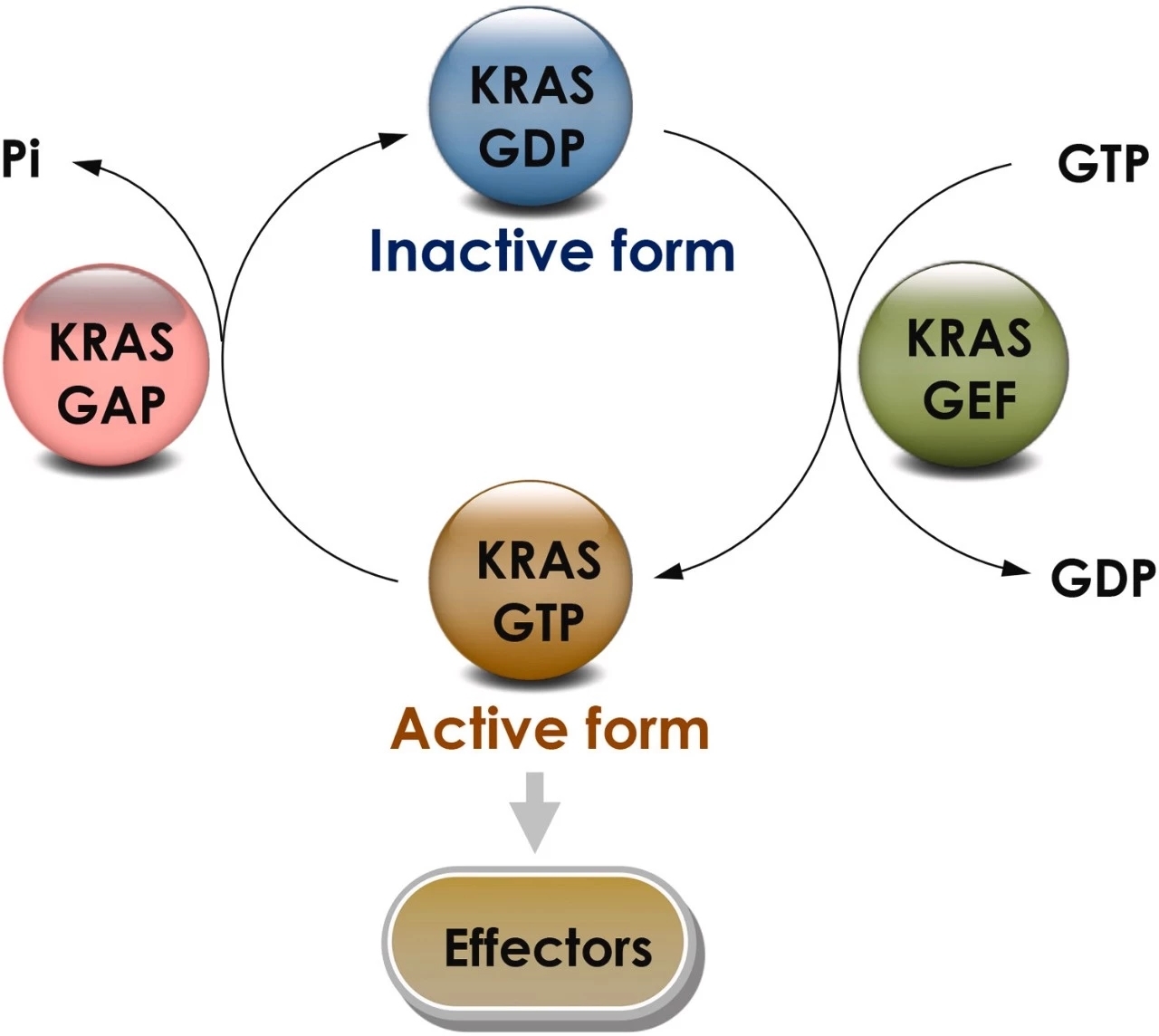
(二)上下游信号通路与活性调节
在正常细胞中,细胞膜上的 EGFR、HER2 等受体单体与配体结合形成二聚体,经自身磷酸化激活下游信号蛋白,其中一条通路可激活 Grb2-Shc,进而激活 SOS 蛋白,最终激活 KRAS 蛋白。
KRAS 蛋白在细胞内可在失活(与 GDP 结合)和激活(与 GTP 结合)状态间转换。激活后的 KRAS 能激活多条下游信号通路,如 MAPK、PI3K 和 Ral-GEFs 信号通路,对细胞生存、增殖和细胞因子释放至关重要。
KRAS 活性受鸟嘌呤核苷酸交换因子(GEF,如 SOS 蛋白)和 GTP 酶激活蛋白(GAPs)的调节。GEF 促进 KRAS 与 GTP 结合使其激活,GAPs 则促进 GTP 水解为 GDP 使 KRAS 失活。

三、KRAS 突变
RAS 在细胞信号网络中处于核心位置,与多种癌症标志相关。KRAS 是 RAS 家族中最常见的亚型,其基因突变占 RAS 基因突变总数的 85%。在多种癌症中,如近 90% 的胰腺癌、30-40% 的结肠癌、17% 的子宫内膜癌以及 15-20% 的肺癌(大多为 NSCLC)等,都存在高比例的 KRAS 基因突变。
在 KRAS 基因突变中,97% 发生在第 12 号或第 13 号氨基酸残基,主要突变类型为 G12D、G12V、G13D。这些突变干扰了 KRAS 水解 GTP 的能力,使 KRAS 持续与 GTP 结合,处于激活状态,不断激活下游信号通路,刺激细胞增殖和迁移,最终导致肿瘤发生。
KRAS 突变不仅直接促进肿瘤细胞增殖和生存,还对肿瘤微环境产生影响。携带 KRAS 突变的肿瘤细胞分泌多种细胞因子,如 IL-6、IL-8 等,可重编程肿瘤微环境中的基质细胞,维持炎症表型;分泌的 GM-CSF 能刺激髓源抑制细胞浸润,抑制抗肿瘤免疫反应。

四、KRAS 检测与靶向药物开发
(一)基因检测方法
目前,针对 KRAS 突变的检测方法主要基于实时荧光定量 PCR 原理。2012 年,FDA 批准 Qiagen 公司的 KRAS 突变检测方法作为西妥昔的伴随诊断;2015 年,FDA 批准罗氏公司的检测方法用于转移性结肠癌的诊断。中国的厦门艾德、武汉友芝友等公司也提供了相关检测试剂盒。
(二)靶向药物开发的挑战
长期以来,KRAS 被视为 “不可成药” 靶点。这是因为 KRAS 蛋白结构无明显结合位点,难以合成靶向抑制其活性的化合物。此外,KRAS 正常活性对许多正常细胞功能至关重要,直接抑制可能导致严重毒性和副作用;且 KRAS 与 NRAS、HRAS 同源性高,抑制 KRAS 活性可能影响其他蛋白。同时,KRAS 与 GDP、GTP 结合力极强,细胞内正常的 GDP、GTP 浓度远高于与 KRAS 结合所需浓度,设计能与之匹敌结合能力的小分子化合物难度极大;设计特异性抑制突变 KRAS 蛋白活性而不影响正常蛋白的药物也面临诸多困难;间接靶向策略同样困难重重,存在毒副作用、补偿逃逸机制和信号反馈冗余等问题。
(三)药物开发策略与进展
近年来,针对 KRAS 突变体的共价抑制剂研究取得突破,如安进公司的 AMG510、Mirati Therapeutics 公司的 MRTX849 等靶向 KRAS G12C 突变体的小分子共价抑制剂已进入临床试验阶段。勃林格殷格翰公司发现的小分子抑制剂 BI-2852,可与 KRAS 的不同 “口袋” 结合,影响其与其他蛋白的结合,具有抗增殖作用。
间接靶向策略也在不断探索中,包括抑制法呢酰基转移酶和 PDEδ 的活性以调节 RAS 与质膜结合;靶向调节 KRAS 活性的蛋白,如勃林格殷格翰的 SOS1 抑制剂、诺华和 Revolution Medicines 公司的 SHP2 抑制剂;通过创新治疗模式间接抑制 KRAS,如靶向蛋白降解剂、RNAi 疗法、反义寡核苷酸疗法和癌症疫苗等;抑制 RAS 效应子信号传导,如开发针对 BRAF 的靶向药物,新一代 RAF 抑制剂正在临床试验中。
尽管 KRAS 靶点的研究面临诸多挑战,但随着科学技术的不断进步,在 KRAS 相关研究和靶向药物开发方面已取得了显著进展,未来有望为肿瘤治疗带来新的突破和希望。













