- 最新进展
- 产品信息
膜蛋白表达与纯化的挑战及解决方案
膜蛋白是细胞膜的重要组成部分,占所有细胞蛋白质组的25%以上。它们在信号传递、细胞黏附和跨膜运输等生理活动中发挥着关键作用。然而,膜蛋白的表达和纯化过程面临诸多挑战,主要原因是它们不溶于水,且从细胞膜中提取时容易失去活性。本文将介绍膜蛋白表达和纯化的常见问题及解决方案,帮助研究人员克服这些难题。
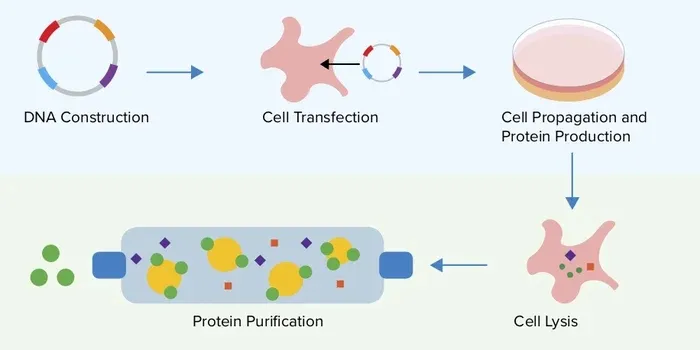
一、膜蛋白表达的建议
改变感受态细胞
使用C41(DE3)感受态大肠杆菌细胞:该菌株在lacUV5启动子中包含一些点突变,以降低转录速率。这种降低的表达速率对宿主细胞更温和,特别适合表达毒性蛋白质。
尝试其他宿主细胞:如果大肠杆菌表达效果不佳,可以考虑使用酵母、昆虫细胞或哺乳动物细胞等真核表达系统。真核细胞能够进行复杂的翻译后修饰,如糖基化和磷酸化,有助于提高膜蛋白的活性。
使用最小生长培养基
降低细胞生长速率:使用不富细菌生长培养基(如M9基础培养基)可能会改善样品表达。降低细胞生长速率可以减少细胞膜中肽折叠错误的可能性。
尝试表达同源物
选择合适的同源基因:如果目标膜蛋白难以表达,可以考虑表达来自其他物种或属的同源基因。一级序列的细微差异可能显著提高蛋白质的稳定性和表达量。
添加可溶性标签
提高表达产量和稳定性:可溶性标签是添加到目标蛋白中的其他氨基酸序列,如果选择得当,可以显著提高表达产量和样品稳定性。例如,绿色荧光蛋白(GFP)是一种常见的选择,因为它使您能够在每一步都使用荧光检测样品。
二、从细胞膜中提取膜蛋白的建议
使用去污剂萃取
去污剂的选择:去污剂是常用的提取试剂,但它们提供的化学环境与细胞膜不同,可能会破坏膜蛋白的四级结构和功能。尽管如此,去污剂非常适合X射线晶体学,因为它们形成的胶束比脂质聚合物和纳米盘组件小,提供了更均匀的样品。
优化去污剂浓度:需要筛选合适的去污剂种类和浓度,以确保膜蛋白的稳定性和活性。
使用纳米圆盘和脂质聚合物进行萃取
保留天然脂质:纳米圆盘和脂质聚合物可以吞噬细胞膜的整个部分,膜蛋白嵌入其中。这种方法可以获得所有天然脂质,使膜蛋白更适合功能检测。
捕获天然寡聚化状态:这种方法更有可能捕获膜蛋白的天然寡聚化状态,但所得复合物的大小可能与某些实验不相容。
控制时间和温度
延长提取时间:无论使用哪种试剂从细胞膜中提取样品,都要留出足够的时间让该过程发生。过夜提取效果通常更好。
适当加热:不要害怕稍微加热混合物。在20–30°C温度下的萃取效率可能比在4°C下高得多。
三、使用镍亲和层析法纯化膜蛋白的建议
使用松散的树脂
促进结合:当谈到膜蛋白纯化时,使用松散填料而不是静态色谱柱更有利于结合。松散的树脂可以与样品进行物理混合,促进结合。
替代方案:如果无法接触到松散的树脂,可以使用蠕动泵上的闭环将样品一遍又一遍地通过色谱柱。
稀释增溶剂
提高结合机会:通过稀释增溶剂(至少2倍)来稀释样品,从而使样品有更好的机会与色谱柱结合。
调整亲和标签
改变标签位置:如果发现混合一天后仍未结合到色谱柱上,可以考虑将亲和标签移动到蛋白的另一端。
延长标签长度:从6×His增加到12×His,或者克隆一些任意残基以将标签推离蛋白质表面。
用钴填充亲和填料
提高纯度:钴采用的氧化态较少,可以提高纯度,但会降低样品回收率。
体积排阻色谱法
提高蛋白纯度:如果需要更高的纯度,使用UV检测的体积排阻色谱法是一个不错的选择。
注意增溶剂的影响:增溶剂会增加样品的质量,并且形状可能很奇怪。这意味着,与细胞质蛋白不同,可能无法从色谱图中确定样品的分子量和低聚物状态。
优化色谱条件:可以通过将样品以尽可能小的体积加载到色谱柱上,或者将去污剂更换为不与色谱柱相互作用或形成较小胶束的去污剂来缓解这种情况。
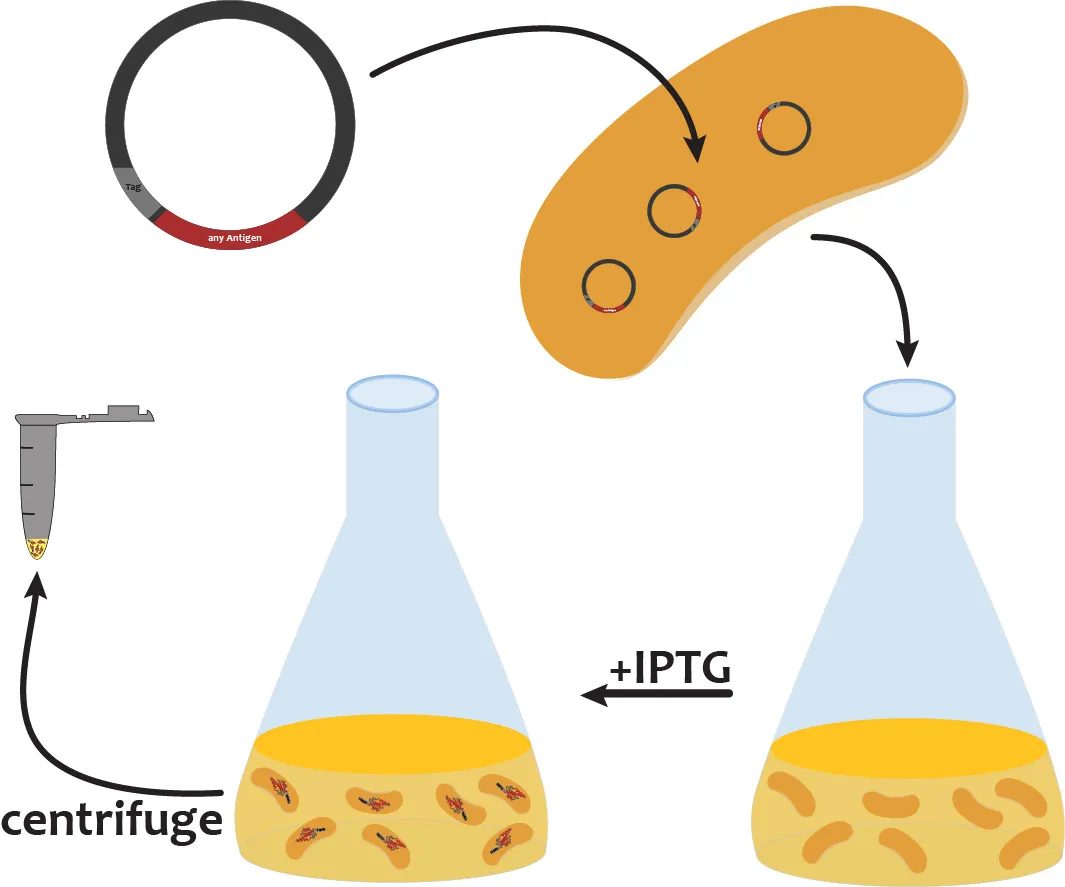
总结
膜蛋白在生物制药中具有重要的应用价值,但其表达和纯化过程面临诸多挑战。通过选择合适的表达系统、优化培养条件、添加可溶性标签以及合理选择纯化方法,可以显著提高膜蛋白的表达效率和纯化效果。希望本文的建议能够帮助研究人员克服膜蛋白研究中的常见问题,推动相关领域的研究进展。













