- 最新进展
- 产品信息
FGFR4变异在肿瘤免疫治疗中的预测价值及机制探索
FGFR4(成纤维细胞生长因子受体4)作为受体酪氨酸激酶家族的重要成员,其信号通路在调控细胞增殖、分化和免疫应答中发挥关键作用。近年来,FGFR4变异在非小细胞肺癌(NSCLC)免疫治疗中的预测价值逐渐受到关注。多项研究表明,FGFR4变异不仅与免疫治疗疗效显著相关,还通过重塑肿瘤免疫微环境影响治疗响应,为优化免疫治疗策略提供了新的分子靶点。
FGFR4变异与免疫治疗疗效的关联性
研究显示,携带FGFR4变异的NSCLC患者在接受免疫检查点抑制剂(ICIs)治疗后,客观缓解率(ORR)显著高于FGFR4野生型患者。在探索队列中,FGFR4变异患者的ORR达50.0%,而野生型患者仅为19.4%。进一步分析发现,FGFR4变异患者的中位无进展生存期(mPFS)和中位总生存期(mOS)均显著延长,且FGFR4变异是PFS(p=0.014)和OS(p=0.005)的独立预测因子。这一现象在多个公共验证队列中得到重复验证,表明FGFR4变异具有跨队列的预测稳定性。
FGFR4变异与肿瘤突变负荷(TMB)的协同作用
TMB是免疫治疗疗效的重要预测指标,但约一半TMB-high患者仍无法从免疫治疗中获益。研究发现,FGFR4变异患者的TMB水平显著高于野生型患者,且在剔除驱动基因变异(如EGFR、ALK等)后,这一关联仍保持显著。在TMB-high亚组中,FGFR4变异患者的mPFS和mOS显著优于野生型患者,提示FGFR4变异可作为TMB的补充指标,进一步筛选可能从免疫治疗中获益的患者。
FGFR4变异对肿瘤免疫微环境的重塑
免疫治疗的疗效高度依赖于肿瘤免疫微环境(TIME)的组成。研究发现,FGFR4变异患者的肿瘤基质中CD8+ T细胞浸润程度显著增加,而CD8+ T细胞是介导抗肿瘤免疫应答的核心效应细胞。此外,FGFR4变异患者肿瘤实质和基质中M1型巨噬细胞(促炎型)与M2型巨噬细胞(免疫抑制型)的比例显著升高,表明FGFR4变异可能通过调节巨噬细胞极化,增强局部免疫应答。这些发现为FGFR4变异预测免疫治疗疗效提供了机制层面的解释。
FGFR4变异的独立预测价值
进一步分析表明,FGFR4变异是独立于驱动基因变异的免疫治疗疗效预测因子。在排除EGFR、ALK等驱动基因变异患者后,FGFR4变异仍与更好的PFS和OS显著相关。此外,FGFR4变异并非NSCLC的预后因素,提示其预测价值仅在免疫治疗背景下显现。这一特性使FGFR4变异成为免疫治疗疗效预测的特异性指标。
FGFR4靶向干预的潜在应用
尽管当前研究聚焦于FGFR4变异的预测价值,但其信号通路的异常激活也为联合治疗提供了理论依据。FGFR4抑制剂可通过阻断FGFR4信号传导,抑制肿瘤细胞增殖,同时可能通过调节肿瘤免疫微环境增强免疫治疗疗效。未来,FGFR4变异检测与FGFR4靶向药物的联合应用,或成为提高免疫治疗响应率的新策略。
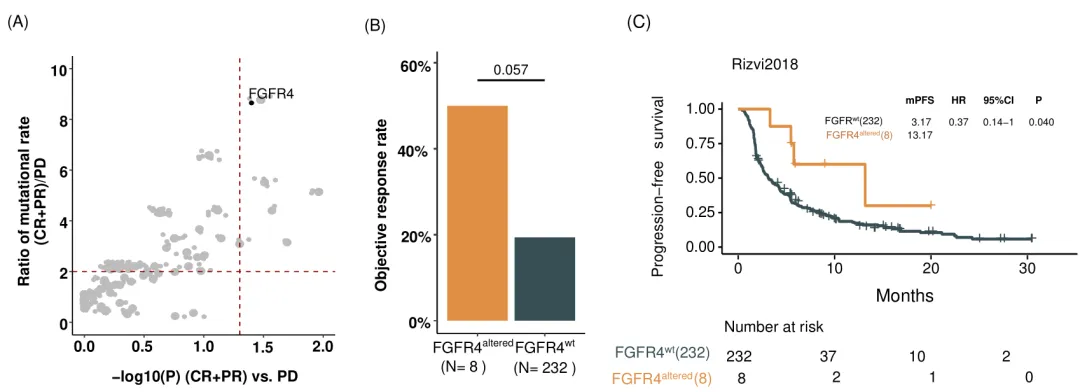
FGFR4变异通过调控肿瘤免疫微环境和TMB水平,显著影响NSCLC患者对免疫治疗的响应。其作为独立预测因子的特性,为免疫治疗提供了新的分子标志物,也为优化治疗策略提供了科学依据。随着对FGFR4信号通路的深入解析,基于FGFR4变异的精准治疗有望成为NSCLC免疫治疗的重要方向。













