- 最新进展
- 产品信息
一、癌症免疫治疗面临哪些关键挑战?
癌症免疫治疗的迅猛发展正在重塑肿瘤治疗格局。免疫检查点抑制剂和过继性T细胞治疗等创新疗法在晚期患者中展现出令人鼓舞的持久疗效。美国FDA已批准多种细胞疗法,包括用于血液恶性肿瘤的CAR-T细胞、用于黑色素瘤的肿瘤浸润淋巴细胞以及用于滑膜肉瘤的T细胞受体疗法。然而,这些"活细胞"疗法促使肿瘤消退的精确分子机制仍然不甚明确,这严重制约了治疗的进一步优化和广泛应用。
传统上,免疫治疗研究主要聚焦于CD8⁺ T细胞的直接杀伤功能,但近年来越来越多的证据表明,B细胞在抗肿瘤免疫中扮演着不可或缺的角色。B细胞不仅能产生特异性抗体,还能作为专业的抗原呈递细胞,并通过分泌细胞因子协调免疫应答。值得注意的是,在多种肿瘤类型中,B细胞浸润和三级淋巴结构的形成与免疫检查点抑制剂的治疗反应呈正相关。这些发现促使研究人员重新审视CD4⁺ T细胞与B细胞在抗肿瘤免疫中的协同作用。
二、Th17细胞为何在过继性T细胞治疗中脱颖而出?
2025年7月24日,Emory大学的Anna C. Cole团队在《Cancer Cell》上发表的重要研究,系统比较了不同CD4⁺ T辅助细胞亚群的抗肿瘤效能。研究人员将表达TRP-1 TCR的CD4⁺ T细胞分别诱导为Th0、Th1、Th9和Th17亚型,随后过继转移至B16F10黑色素瘤小鼠模型中。令人瞩目的是,在不依赖疫苗或外源性IL-2支持的情况下,Th17细胞展现出显著优于其他亚群的肿瘤抑制能力。

这种卓越的抗肿瘤效果并非短暂现象。研究团队进一步在经Th17细胞治愈的小鼠中静脉注射B16F10肿瘤细胞,评估其对肺转移的防护能力。结果显示,这些小鼠完全未形成肺部转移灶。更为重要的是,即使通过抗体清除体内的CD4⁺ T细胞,这种保护效应依然存在,表明Th17细胞诱导的长效免疫不依赖于效应细胞的持续存在。这一发现为理解过继性T细胞治疗的长期获益提供了全新视角。
三、Th17细胞如何通过独特机制激活宿主B细胞?
为阐明Th17细胞介导抗肿瘤免疫的分子机制,研究人员利用NanoString技术对肿瘤组织及肿瘤引流淋巴结进行了全面的转录组分析。结果显示,在肿瘤微环境中,抗原呈递相关基因和干扰素信号通路显著增强,包括Cd74、H2-Aa和Tap1等关键分子。而在引流淋巴结中,B细胞相关基因如Cd19、Aicda、Cd40L和Il21明显上调,提示B细胞活化与Th17治疗密切相关。
为进一步验证这一假设,研究团队在T细胞缺陷和T/B细胞联合缺陷的小鼠模型中评估Th17细胞的疗效。在TCRα⁻/⁻小鼠中,Th17细胞仍能发挥显著的抗肿瘤作用;然而,在RAG⁻/⁻小鼠中,该效应完全丧失。随后,通过在B细胞特异性缺陷和B细胞清除的小鼠模型中重复实验,研究人员确认宿主B细胞对Th17细胞的治疗效果至关重要。这一系列严谨的实验首次明确了B细胞在Th17介导的抗肿瘤免疫中的核心地位。
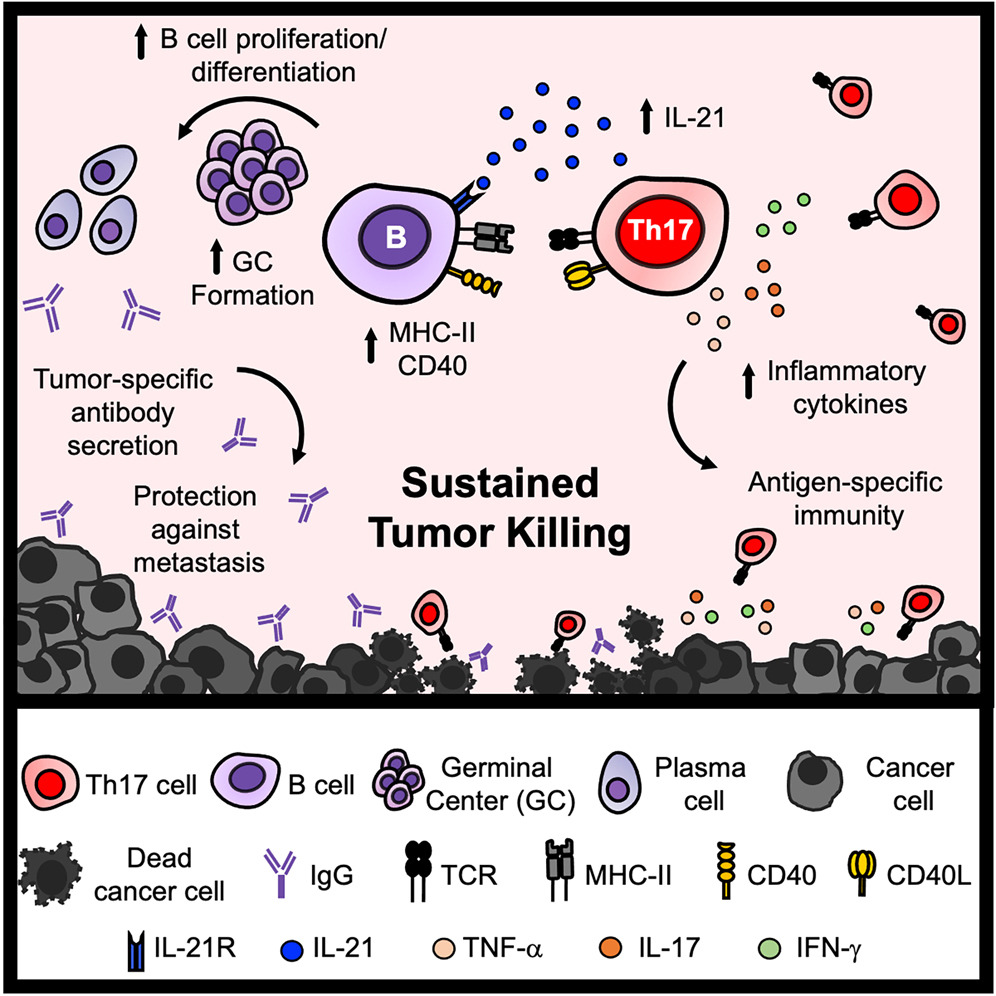
四、Th17细胞如何重塑B细胞功能状态?
通过流式细胞术深入分析脾脏B细胞亚群,研究发现Th17治疗显著增加了浆细胞和生发中心B细胞的比例。同时,B细胞的增殖标志物Ki-67表达上调,MHC-II、CD40和CD86等共刺激分子的表达也明显增强,表明B细胞处于高度活化状态。这些发现从细胞水平揭示了Th17治疗对B细胞功能的深刻影响。
组织学分析进一步提供了空间层面的证据。免疫荧光染色显示,Th17细胞能够特异性浸润B细胞滤泡,促进GL7⁺活化B细胞的聚集,并增加生发中心的数目和大小。这种结构性改变为B细胞的充分活化和抗体亲和力成熟提供了理想的微环境,可能是持久免疫记忆形成的基础。
五、CD40/CD40L通路在Th17-B细胞对话中起何作用?
细胞间相互作用的分子机制是本研究的关键焦点。研究人员发现,CD40/CD40L信号通路在介导Th17细胞与B细胞的协同作用中扮演核心角色。当使用抗CD40L抗体阻断这一通路时,Th17细胞的治疗效果显著受损,证实CD40L是Th17细胞驱动B细胞反应的关键分子。
深入的分析揭示了一个有趣的正反馈环路:B细胞不仅能响应Th17细胞提供的CD40L信号,还能反过来增强Th17细胞的多功能性。在B细胞缺失的环境中,Th17细胞更多维持中央记忆表型,其多细胞因子产生能力明显下降,包括IL-21、TNFα和IL-10等重要细胞因子的分泌减少。这一发现颠覆了传统上认为T细胞单向调控B细胞的观念,揭示了免疫细胞间复杂的双向对话机制。
六、IL-21如何协调长效抗肿瘤免疫?
IL-21作为Th17细胞的特征性细胞因子,其在抗肿瘤免疫中的作用机制一直是领域内关注的焦点。本研究通过精巧的实验设计,揭示了IL-21在维持长效免疫中的特殊地位。当使用抗IL-21R抗体阻断IL-21信号,或在IL-21R⁻/⁻小鼠中进行Th17治疗时,研究人员观察到截然不同的时空效应:初始的肿瘤清除阶段基本不受影响,但长期的免疫保护明显受损。
机制研究表明,IL-21主要通过作用于B细胞而非自分泌方式影响Th17细胞功能。IL-21信号的缺失导致B细胞增殖受阻,浆细胞分化和生发中心形成受限,进而影响高质量抗体的产生和免疫记忆的建立。这一发现解释了为何IL-21阻断不影响早期疗效却损害长期保护,也为理解Th17细胞介导的持久免疫提供了关键分子解释。
七、Th17-B细胞轴对癌症免疫治疗有何临床意义?
本研究系统阐明了Th17细胞通过IL-21和CD40L与宿主B细胞相互作用,促进B细胞活化和抗体生成,从而实现持久抗肿瘤免疫的完整机制。这一发现不仅拓展了我们对过继性T细胞治疗作用机制的理解,也为优化现有免疫治疗策略提供了重要启示。
从转化医学视角,这些发现提示我们应当重新评估当前以CD8⁺ T细胞为中心的过继性T细胞治疗策略。通过合理利用Th17细胞的独特优势,特别是其与B细胞的协同作用,可能为实体瘤治疗开辟新的途径。同时,针对CD40L和IL-21通路的精准调控,有望进一步增强现有疗法的效力和持久性。
此外,研究结果还提示B细胞状态可能作为预测Th17治疗反应的生物标志物,为患者分层和个性化治疗提供新依据。随着对Th17-B细胞相互作用机制的深入理解,我们有理由相信,基于这些科学见解的新型治疗策略将为更多癌症患者带来希望。
本研究不仅揭示了Th17细胞在抗肿瘤免疫中的新颖机制,更重要的是确立了CD4⁺ T细胞与B细胞协同作用在癌症免疫治疗中的核心地位,为下一代免疫治疗技术的开发奠定了坚实的理论基础。













