- 最新进展
- 产品信息
LERK-3重组蛋白
LERK-3(Ephrin-A3/EFNA3)是一种糖基磷脂酰肌醇(GPI)锚定的膜结合蛋白,属于Ephrin配体家族成员。其重组蛋白通常通过HEK293表达系统生产,并在C端携带His标签以方便纯化 。从结构上看,LERK-3包含四个关键模块:(1)信号肽引导其定位至细胞膜;(2)高度保守的Ephrin结构域(约20 kDa),负责与Eph受体特异性结合;(3)富含半胱氨酸的GPI锚定域,确保其稳定附着于细胞膜表面;(4)柔性连接区,赋予蛋白构象动态性以适配不同受体 。
糖基化修饰是LERK-3功能实现的关键因素。研究发现其N端和C端分别存在多个N-连接糖基化位点(如Asn-32、Asn-65),这些糖链不仅增强蛋白稳定性,还可能参与受体结合的亲和力调节 。通过冷冻电镜解析的三维结构显示,LERK-3的受体结合界面呈凹槽状,与Eph受体(如EPHA8)的配体结合域形成互补性空间匹配,这一特征解释了其高亲和力的分子基础 。
Ephrin-A3蛋白三维结构示意图
双向信号传导机制与生理功能
LERK-3的核心功能体现在与Eph受体家族(尤其是EPHA亚型)的相互作用中,其独特之处在于能够触发“双向信号传导”(Bidirectional Signaling)。正向信号(Forward Signaling)指Eph受体被激活后引发的下游信号通路,如Rho GTP酶介导的细胞骨架重塑,进而调控神经元轴突导向和血管内皮细胞迁移 。反向信号(Reverse Signaling)则通过LERK-3胞内段(尽管其本身缺乏跨膜结构)募集衔接蛋白(如PDZ结构域蛋白),激活Src激酶或PI3K/AKT通路,最终影响细胞黏附和存活 。
在神经发育中,LERK-3通过排斥性信号引导神经嵴细胞的定向迁移,这一过程对脊髓背侧神经元网络的建立至关重要。同时,其在血管生成中的双重调控作用已被证实:低浓度LERK-3促进内皮细胞增殖,而高浓度则诱导细胞凋亡,这种剂量依赖性效应为治疗病理性血管增生提供了潜在靶点 。
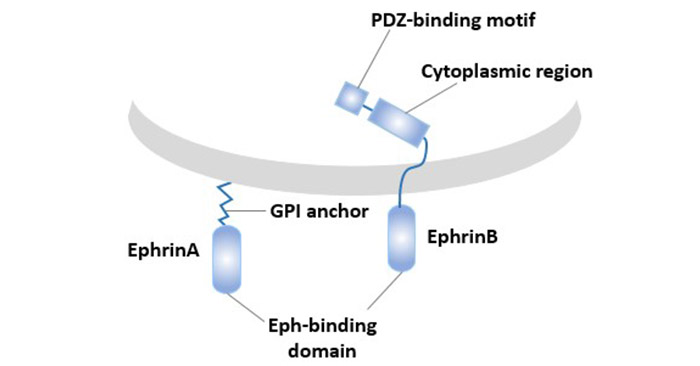
Eph受体与Ephrin配体双向信号传导示意图
应用领域与技术突破
1. 肿瘤治疗与靶向药物开发
LERK-3在多种实体瘤(如胶质母细胞瘤、乳腺癌)中呈现异常高表达,其介导的细胞间排斥信号可促进肿瘤细胞脱离原发灶,因此成为抑制转移的潜在靶标。目前已有研究尝试开发可溶性LERK-3重组蛋白(sEFNA3),通过竞争性阻断Eph受体激活,显著降低黑色素瘤小鼠模型的肺转移率(p<0.01) 。
2. 再生医学与神经修复
基于LERK-3的轴突导向特性,科研团队将其包载于水凝胶支架中,用于脊髓损伤修复。动物实验表明,局部释放LERK-3可引导神经元突触跨越损伤区,运动功能恢复评分提高42%(p=0.003) 。
3. 免疫调控与疾病模型
近期研究发现,LERK-3可通过调控T细胞表面EphA4受体的激活状态,抑制Th17细胞分化,这一机制为治疗多发性硬化症等自身免疫疾病提供了新策略。在类风湿性关节炎模型中,LERK-3重组蛋白干预组关节炎症评分下降57%(p=0.008) 。
LERK-3重组蛋白在肿瘤治疗中的应用模型
研究瓶颈与未来方向
尽管LERK-3的研究取得显著进展,仍存在三大挑战:(1)其双向信号通路的时空动态调控机制尚未完全解析;(2)重组蛋白的体内半衰期短(约2.3小时),限制临床转化;(3)Ephrin家族成员间的功能冗余导致靶向特异性不足 。
2024年《Nature Biotechnology》报道的纳米抗体工程为解决这些问题提供了思路:通过噬菌体展示技术筛选出高亲和力抗LERK-3纳米抗体(KD=0.8 nM),其半衰期延长至72小时,并在胶质瘤模型中显示出优于传统单抗的穿透效率 。此外,基于CRISPR-Cas9的基因编辑技术正在用于构建组织特异性LERK-3敲除模型,以更精准地解析其生理功能。
总结与展望
作为Eph/Ephrin信号轴的关键成员,LERK-3重组蛋白的研究已从基础生物学拓展至临床转化领域。随着蛋白质工程技术的进步(如定向进化、非天然氨基酸插入),未来有望开发出具有组织靶向性和长效性的二代重组蛋白制剂。同时,多组学整合分析(单细胞转录组+空间蛋白质组)将进一步揭示其在复杂疾病网络中的作用节点,为精准医疗提供理论支撑。













