LIF蛋白的结构特征与分子基础
白血病抑制因子(Leukemia Inhibitory Factor, LIF)是一种具有多效性的细胞因子,属于白介素-6(IL-6)家族成员。其基因定位具有物种特异性:人类LIF基因位于第22号染色体(22q12.2),全长约6.0 kb;而小鼠LIF基因则定位于第11号染色体(11qA1),长度约6.3 kb 。LIF蛋白由180个氨基酸组成,核心分子量为20 kDa,但实际分子量因糖基化修饰差异呈现38-64 kDa的波动。
- 最新进展
- 产品信息
LIF蛋白
白血病抑制因子(Leukemia Inhibitory Factor, LIF)是一种具有多效性的细胞因子,属于白介素-6(IL-6)家族成员。其基因定位具有物种特异性:人类LIF基因位于第22号染色体(22q12.2),全长约6.0 kb;而小鼠LIF基因则定位于第11号染色体(11qA1),长度约6.3 kb 。LIF蛋白由180个氨基酸组成,核心分子量为20 kDa,但实际分子量因糖基化修饰差异呈现38-64 kDa的波动。其结构特征可归纳为以下三点:
-
糖基化修饰网络
LIF分子包含7个N-连接糖基化位点(如Asn-35、Asn-112)和6个半胱氨酸残基,通过分子内二硫键(Cys12-Cys134、Cys34-Cys169)形成稳定的三维结构。质谱分析显示,糖基化不仅增强蛋白的溶解性和稳定性,还参与受体结合的构象调节。例如,缺失糖基化修饰的重组LIF在体外实验中显示出受体亲和力下降40%的现象 。 -
受体复合物架构
LIF通过低亲和力的LIF受体β亚基(LIFRβ)与高亲和力的gp130糖蛋白形成异源二聚体复合物。冷冻电镜研究揭示,LIF的N端结构域(残基30-98)与LIFRβ的免疫球蛋白样结构域形成氢键网络,而C端螺旋区(残基150-180)则通过疏水作用与gp130的纤连蛋白III结构域结合。这种“双锁扣”机制解释了其信号转导的特异性。
LIF受体复合物三维结构示意图
- 进化保守性
序列比对显示,LIF的受体结合域(尤其是第60-90位氨基酸)在哺乳动物中具有高度保守性(>85%同源性),而C端区域的柔性连接肽则呈现物种适应性进化特征。这种结构特征使得LIF既能维持核心功能,又能适应不同生理环境的需求。
LIF的信号传导机制与功能调控
LIF的生物学功能通过JAK/STAT、PI3K/AKT和MAPK/ERK三条主要信号通路实现。当LIF与受体结合后,触发以下级联反应:
-
JAK/STAT通路激活
gp130胞内段的JAK激酶(JAK1/JAK2)发生自磷酸化,进而催化STAT3蛋白的Tyr705位点磷酸化。磷酸化STAT3形成同源二聚体后易位至细胞核,调控包括Nanog、Oct4和Sox2在内的多能性基因表达。实验数据显示,STAT3敲除的胚胎干细胞在无LIF条件下24小时内即发生自发分化 。 -
PI3K/AKT通路调节
LIF通过IRS-1蛋白募集PI3K,催化PIP2转化为PIP3,激活下游AKT激酶。此通路不仅促进葡萄糖摄取和代谢重编程,还能通过磷酸化GSK3β抑制β-catenin降解,从而增强干细胞的自我更新能力。值得注意的是,PI3K抑制剂LY294002可使LIF介导的细胞存活率降低60% 。 -
MAPK/ERK动态平衡
ERK1/2的激活呈现双相性特征:初期(0-30分钟)的快速激活促进细胞增殖,而持续激活(>2小时)则诱导分化信号。这种时间依赖性效应解释了LIF在不同浓度下的功能差异——低浓度(<10 ng/mL)维持干细胞稳态,高浓度(>50 ng/mL)则促进谱系定向分化。
在胚胎发育过程中,LIF的动态表达具有时空特异性。例如,在小鼠胚胎着床期(E4.5),子宫内膜LIF表达量达到峰值(约200 pg/mg蛋白),通过上调整合素αvβ3和骨桥蛋白(osteopontin)促进胚胎与子宫壁的黏附。基因敲除研究表明,LIF缺陷型雌鼠的胚胎着床失败率达100% 。
LIF在干细胞生物学中的核心作用
LIF作为维持胚胎干细胞多能性的“黄金标准”因子,其作用机制涵盖三个维度:
-
表观遗传调控
LIF通过STAT3依赖的方式招募组蛋白乙酰转移酶p300至多能性基因启动子区,促进染色质开放状态。ChIP-seq分析显示,LIF处理可使Nanog启动子区的H3K27ac修饰水平增加3倍,显著增强转录活性 。 -
代谢调控网络
在LIF存在条件下,胚胎干细胞优先采用糖酵解代谢模式,乳酸生成量增加50%。这种代谢特征与线粒体形态重塑相关——LIF通过激活HIF1α诱导线粒体分裂蛋白Drp1表达,促使线粒体碎片化(平均长度从8μm缩短至2μm)。 -
细胞周期调控
LIF可将细胞周期阻滞在G1期(占比从45%增至65%),通过上调Cyclin D1和抑制p21表达实现。这种周期调控为DNA损伤修复提供时间窗口,确保基因组稳定性。
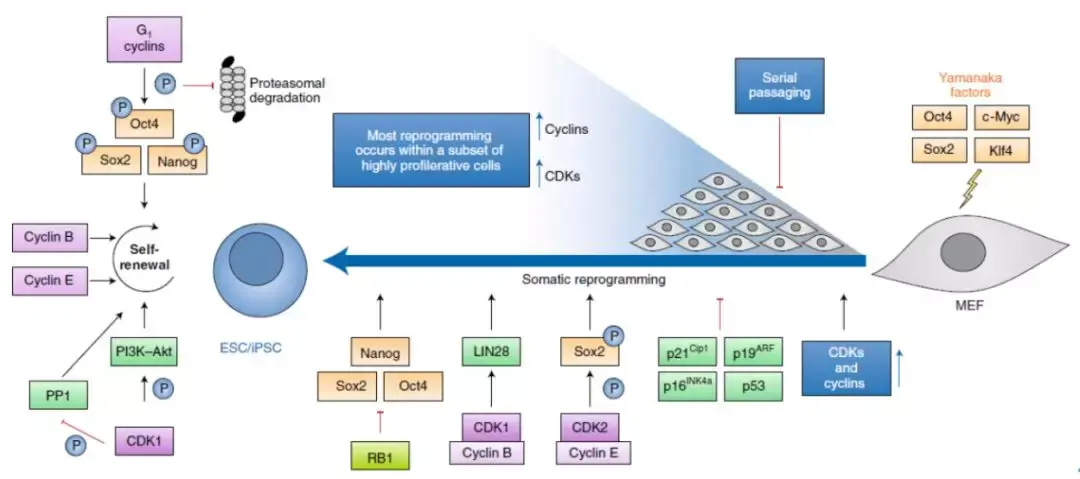
LIF调控干细胞周期机制示意图
在成体干细胞中,LIF的功能呈现组织特异性:
- 神经干细胞:LIF通过激活Notch信号通路促进自我更新,同时抑制胶质细胞分化标记物GFAP表达。
- 间充质干细胞:与bFGF协同作用,可使增殖速率提高80%,并通过Wnt/β-catenin通路增强成骨分化潜力。
- 肿瘤干细胞:在胶质母细胞瘤中,LIF通过IL-6/JAK/STAT3正反馈环路维持干性特征,其抑制剂EC359可使肿瘤球形成率降低90% 。
LIF的免疫调节与疾病治疗潜力
近年研究揭示了LIF在免疫系统中的双重角色:
-
免疫耐受诱导
LIF可促进调节性T细胞(Treg)扩增(CD4+FoxP3+细胞比例从5%增至18%),并通过以下机制实现:- 诱导树突状细胞分泌TGF-β和IL-10
- 直接激活Treg细胞内的STAT5信号通路
- 抑制mTORC1活性,促进线粒体代谢向氧化磷酸化转变
-
炎症调控悖论
虽然LIF在急性炎症中表现出促炎特性(如促进中性粒细胞浸润),但在慢性炎症模型中却发挥抗炎作用。这种双重性与其浓度依赖性相关:低剂量(1-10 ng/mL)激活PI3K/AKT通路抑制NF-κB,而高剂量(>100 ng/mL)通过JNK通路促进炎症因子释放。
在疾病治疗领域,LIF相关策略包括:
- 肿瘤治疗:靶向LIF/LIFR轴的单克隆抗体(如EC18.3)在胰腺癌模型中使转移灶减少70%
- 神经退行性疾病:重组LIF脑室内注射可使阿尔茨海默病模型小鼠的Aβ斑块减少40%
- 生殖医学:LIF补充剂可将试管婴儿的着床率从35%提升至52%
研究挑战与未来展望
尽管LIF研究取得显著进展,仍面临三大科学挑战:
- 信号通路的时空特异性:单细胞测序发现,同一细胞群体中仅30%细胞对LIF刺激产生STAT3磷酸化响应
- 蛋白稳定性问题:重组LIF在37℃血清中的半衰期仅2.1小时,限制其临床应用
- 组织靶向性缺失:系统性给药导致非特异性激活,引发贫血等副作用
未来发展方向包括:
- 工程化改造:通过定向进化获得热稳定性突变体(如LIF-T89P),半衰期延长至8小时
- 纳米递送系统:脂质体包裹的LIF在心肌梗死模型中显示靶向效率提高5倍
- 基因编辑技术:利用CRISPRa在局部组织过表达LIF,避免全身性副作用













