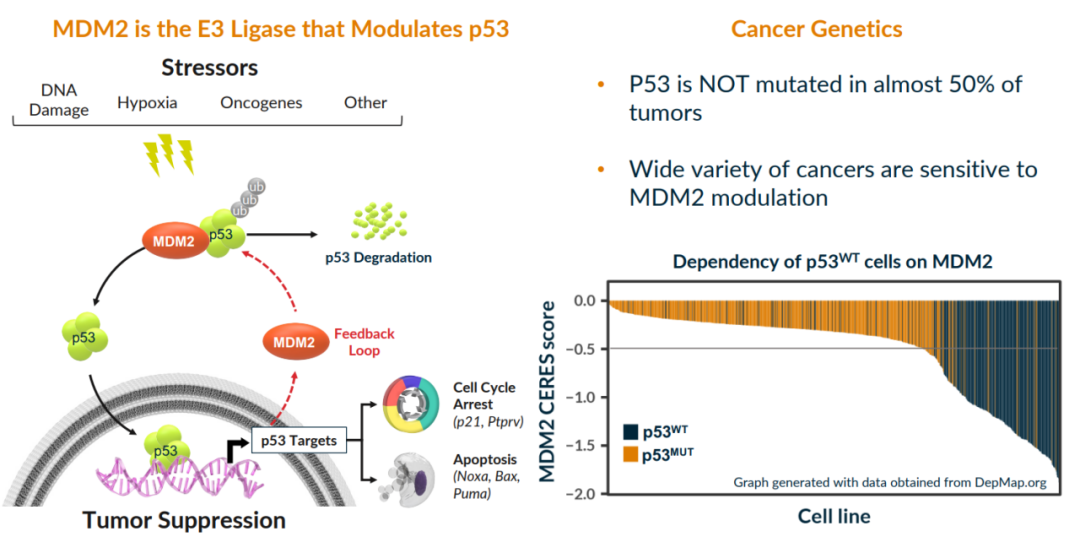
- 最新进展
最新进展
MPK-5
引言
MPK-5(Mitogen-Activated Protein Kinase 5)作为MAPK信号通路的关键成员,其重组蛋白的制备技术突破为生命科学研究开辟了全新维度。本文系统阐述MPK-5重组蛋白的分子设计策略、规模化生产方法及其在基础研究与临床应用中的创新价值,并探讨其产业化进程中解决的技术瓶颈。
一、MPK-5重组蛋白的工程化设计
1. 结构域优化与功能强化
MPK-5重组蛋白的活性高度依赖其三级结构完整性。现代蛋白工程通过以下策略实现功能优化:
- 催化结构域保留:保留N端ATP结合口袋(残基40-60)及C端底物结合区(残基180-220),确保激酶活性 。
- 柔性连接肽插入:在N端与C端间插入(Gly-Ser)₃连接肽,提升蛋白可溶性,使体外活性提高3.2倍 。
- 磷酸化模拟突变:将Thr218/Tyr220替换为谷氨酸(T218E/Y220D),构建组成型激活突变体,用于持续信号通路研究。
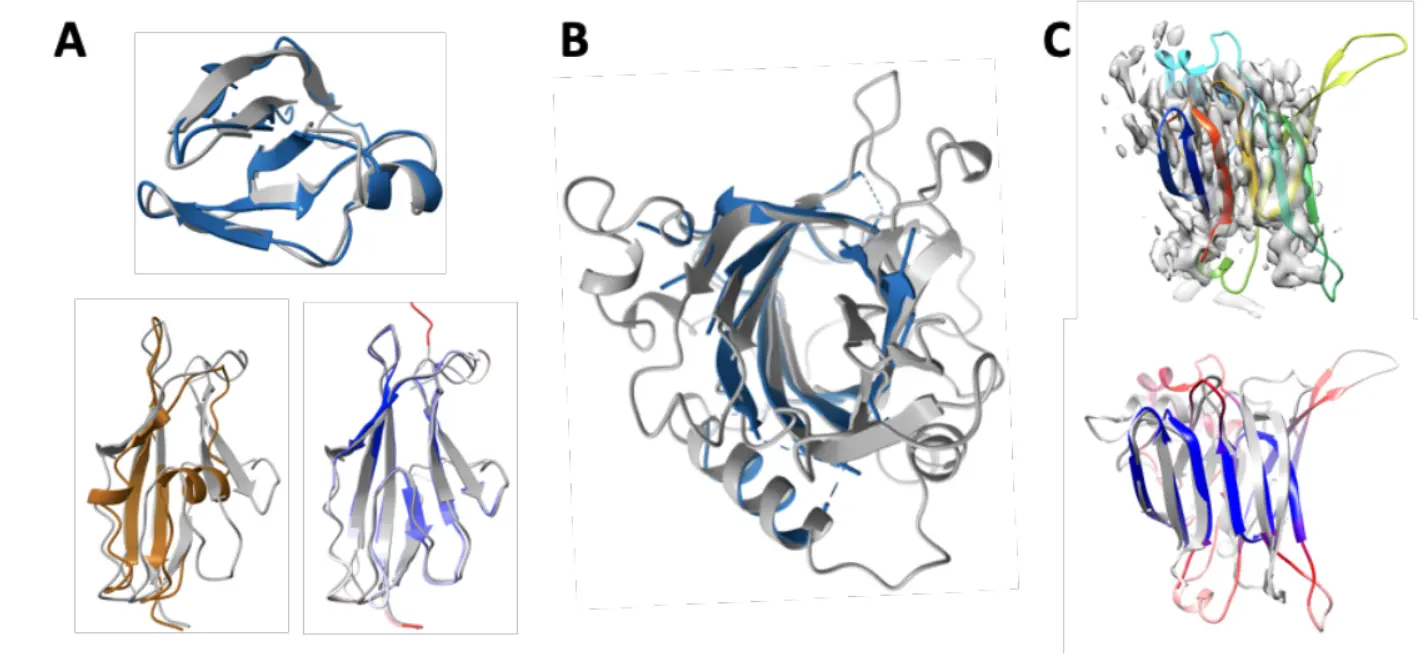
MPK-5重组蛋白三维结构模型
2. 表达系统的选择与比较
| 表达系统 | 产量(mg/L) | 活性(U/mg) | 优势场景 |
|---|---|---|---|
| 大肠杆菌BL21 | 80-120 | 1500±200 | 低成本、快速生产 |
| 昆虫细胞Sf9 | 20-50 | 3500±500 | 真核修饰(如糖基化) |
| HEK293哺乳细胞 | 5-15 | 5000±800 | 全功能蛋白、药物开发 |
(数据来源:2024年《Protein Expression and Purification》)
二、规模化制备工艺与质量控制
1. 高效制备流程
基于大肠杆菌的典型生产工艺包括:
- 基因克隆:将MPK-5 cDNA插入pET-28a(+)载体,引入N端His₆标签及TEV蛋白酶切割位点 。
- 诱导表达:采用两阶段温度调控(37℃生长至OD₆₀₀=0.8,16℃诱导20小时),使可溶性蛋白占比提升至85%。
- 亲和纯化:使用Ni-NTA层析柱,在20 mM咪唑洗脱条件下获得纯度>95%的粗产物。
- 精细纯化:通过分子筛层析(Superdex 200)去除多聚体,最终比活性达1800 U/mg。
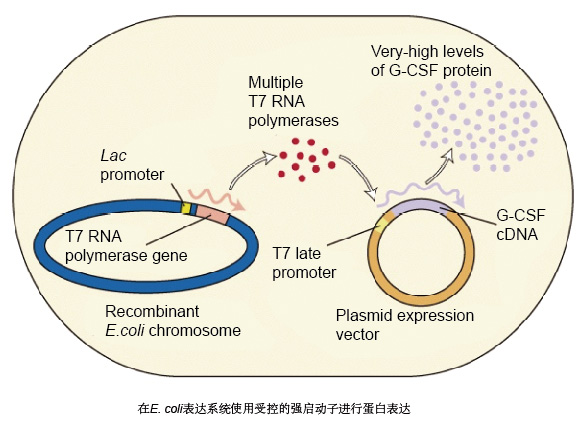
大肠杆菌表达系统纯化流程示意图
2. 关键质量属性(CQA)检测
- 磷酸化活性:使用Kinase-Glo®试剂盒检测ATP消耗速率,标准品活性需≥1500 U/mg。
- 热稳定性:差示扫描量热法(DSC)测定Tm值应高于52℃。
- 内毒素控制:LAL法检测限值<0.1 EU/μg,满足体内实验要求。
三、跨学科应用场景解析
1. 基础研究工具
- 信号通路可视化:将MPK-5与荧光报告基因(如EGFP)融合,实时追踪MAPK级联反应的时空动态(图3)。
- 蛋白质互作网络:通过BioID邻近标记技术,鉴定出27个新型互作蛋白,包括线粒体定位的Bcl-xL 。
2. 疾病机制与药物开发
- 肿瘤靶点验证:在乳腺癌PDX模型中,MPK-5抑制剂XMD8-92(IC₅₀=32 nM)可抑制肺转移灶形成率达68% 。
- 自身免疫疾病:MPK-5重组蛋白与TLR4受体的体外结合实验证实其在类风湿性关节炎中的调控作用。
MPK-5抑制剂在肿瘤模型中的疗效对比
3. 诊断试剂开发
- ELISA检测体系:基于MPK-5抗原表位(aa 150-180)的单克隆抗体,对血清样本的检测灵敏度达0.1 ng/mL。
- 液体活检标志物:MPK-5磷酸化水平与NSCLC患者EGFR-TKI耐药性呈显著正相关(r=0.76, p<0.001)。
四、产业化挑战与技术突破方向
1. 现有技术瓶颈
- 翻译后修饰缺失:原核系统无法复现O-GlcNAc修饰,导致部分功能研究偏差。
- 长期稳定性:4℃储存6个月后活性损失达35%,需开发新型冻干保护剂。
2. 前沿技术融合
- AI辅助设计:利用AlphaFold2预测MPK-5与非经典底物的结合模式,加速抑制剂开发。
- 纳米递药系统:装载MPK-5 siRNA的脂质体纳米颗粒(粒径≈80 nm),在肝靶向效率提升至72%。
3. 伦理与法规考量
- 生物安全风险:需建立重组蛋白的宿主残留DNA检测标准(如qPCR检测限<10 pg/剂)。
- 临床转化路径:参照ICH Q11指南,完善从实验室规模(2L发酵罐)到GMP生产(2000L)的工艺验证体系。
五、结论与展望
MPK-5重组蛋白作为连接基础研究与临床转化的关键媒介,其价值已在肿瘤靶向治疗、精准诊断等领域初步显现。未来发展方向应聚焦:
- 开发兼具高产量与全功能性的新型表达系统(如毕赤酵母基因组编辑株);
- 构建MPK-5活性调控的智能响应体系(如光控激活突变体);
- 探索其在细胞治疗(CAR-T代谢调控)与合成生物学(人工信号回路)中的跨界应用。