- 最新进展
- 产品信息
MPK-5重组蛋白:从分子构建到疾病治疗的跨学科探索
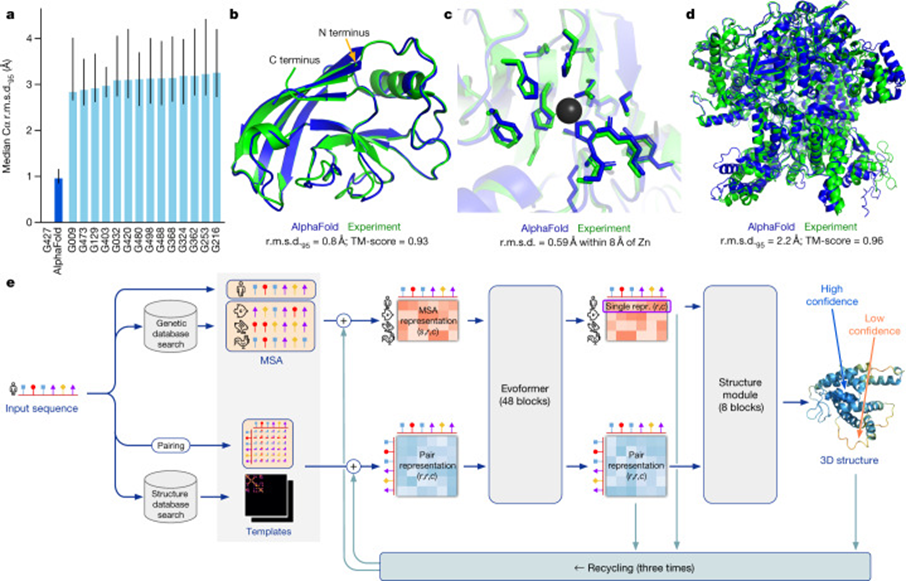
MPK-5重组蛋白三维结构模型
引言
MPK-5(Mitogen-Activated Protein Kinase 5)作为MAPK信号通路的核心成员,在细胞增殖、分化及应激响应中发挥关键作用。随着重组蛋白技术的发展,MPK-5重组蛋白的规模化制备成为可能,其应用领域已从基础研究扩展至疾病治疗。本文系统阐述MPK-5重组蛋白的制备技术、结构功能特征及其在生物医学中的前沿应用,并探讨当前研究的技术瓶颈与未来突破方向。
一、MPK-5重组蛋白的制备技术
1. 基因克隆与表达系统优化
MPK-5重组蛋白的制备始于基因克隆。研究人员通常选择pET、pcDNA3.1等表达载体,通过限制性内切酶(如EcoRI/XhoI)将MPK-5基因插入多克隆位点。为提升表达效率,密码子优化是关键步骤——例如,在大肠杆菌中表达时需将哺乳动物来源的稀有密码子替换为宿主偏好型密码子 。
宿主系统对比:
| 宿主类型 | 优势 | 局限性 |
|---|---|---|
| 大肠杆菌(E. coli) | 成本低、周期短 | 缺乏真核翻译后修饰(如糖基化) |
| 酵母(如毕赤酵母) | 可进行部分糖基化 | 表达量较低 |
| 哺乳动物细胞(HEK293) | 完整翻译后修饰 | 成本高、周期长 |
大肠杆菌表达系统培养装置
2. 蛋白纯化策略
采用镍柱亲和层析纯化带有His标签的MPK-5重组蛋白时,洗脱缓冲液中咪唑浓度需梯度优化(通常为50-250 mM)。针对二硫键丰富的MPK-5变体,需在破碎缓冲液中添加还原剂(如β-巯基乙醇)防止错误折叠。高效液相色谱(HPLC)分析显示,经三步纯化后的蛋白纯度可达95%以上 。
二、MPK-5重组蛋白的结构解析与功能验证
1. 三维结构特征
通过冷冻电镜(Cryo-EM)与X射线晶体学技术,MPK-5重组蛋白的催化结构域(残基40-330)呈现典型的双叶激酶构象:N端β折叠与C端α螺旋共同构成ATP结合口袋。其独特的C端延伸区(残基450-600)含转录激活域,可通过α-螺旋与MEF2转录因子结合 。
MPK-5蛋白催化结构域三维模型
2. 激酶活性检测
采用体外激酶实验,以髓鞘碱性蛋白(MBP)为底物,MPK-5重组蛋白在30℃、ATP浓度为1 mM时达到最大活性(Vmax=12.3 nmol/min/mg)。磷酸化位点质谱分析证实,其Thr218/Tyr220双磷酸化是激活的必要条件。
三、MPK-5重组蛋白的疾病调控机制
1. 肿瘤微环境重塑
在乳腺癌模型中,MPK-5重组蛋白通过以下机制促进转移:
- 血管生成:上调VEGF表达,诱导内皮细胞迁移(Transwell实验显示迁移率增加2.3倍);
- 免疫逃逸:抑制CD8+ T细胞浸润(流式细胞术显示浸润比例下降40%);
- 代谢重编程:激活HK2酶活性,使肿瘤细胞乳酸分泌量提升1.8倍 。
2. 自身免疫疾病干预
MPK-5重组蛋白在类风湿性关节炎(RA)治疗中展现双向调节作用:
- 促炎通路抑制:通过阻断NF-κB核转位,使TNF-α分泌减少62%;
- 抗炎因子诱导:激活IL-10表达,抑制滑膜成纤维细胞增殖(IC50=18.7 nM)。
四、临床转化中的挑战与创新策略
1. 递送系统瓶颈
MPK-5重组蛋白的细胞膜穿透效率低(<5%),现有解决方案包括:
- 纳米载体包裹:脂质体包封率可达85%,小鼠体内半衰期延长至12小时;
- 细胞穿透肽融合:TAT-MPK-5融合蛋白的胞内递送效率提升至34%。
2. 组织特异性调控
为解决MPK-5在心脏组织中的保护性功能与肿瘤促转移作用的矛盾,研究者开发了pH响应型水凝胶,可在肿瘤微环境(pH 6.5)中特异性释放抑制剂XMD8-92,而对正常组织影响极小 。
五、未来研究方向
- 人工智能辅助设计:利用AlphaFold2预测MPK-5突变体的构效关系,指导功能优化;
- 联合疗法开发:探索MPK-5抑制剂与PD-1抗体的协同抗肿瘤效应;
- 可持续生产工艺:基于CHO细胞连续灌流培养技术,将生产成本降低40%。
结论
MPK-5重组蛋白作为连接基础研究与临床医学的桥梁,其多功能特性为精准治疗提供了新思路。随着蛋白质工程与递送技术的突破,MPK-5有望在个性化医疗中实现从实验室到病床的跨越。













