- 最新进展
- 产品信息
SHPS1:巨噬细胞调控肿瘤免疫的关键“信号开关” ——从基础机制到治疗突破
一、SHPS1的生物学特性与功能
SHPS1(SHP substrate 1),又称SIRPα(Signal Regulatory Protein α),是免疫球蛋白超家族成员,主要表达于巨噬细胞、树突状细胞等髓系细胞表面。其胞内段含有免疫受体酪氨酸抑制基序(ITIM),可招募酪氨酸磷酸酶SHP-1和SHP-2,调控下游信号通路。
SHPS1的核心功能是通过与配体CD47结合传递“别吃我”信号。正常生理状态下,CD47在红细胞等健康细胞表面高表达,通过与巨噬细胞SHPS1结合,抑制巨噬细胞的吞噬作用,避免自身组织被误伤。然而,肿瘤细胞会劫持这一机制,通过过表达CD47伪装成“健康细胞”,逃避免疫清除,这一过程被称为“免疫逃逸”的经典途径。
二、SHPS1/CD47轴在肿瘤免疫抑制中的作用
- 抑制巨噬细胞吞噬功能
肿瘤细胞高表达的CD47与巨噬细胞SHPS1结合后,激活SHP-1/SHP-2磷酸酶,导致肌球蛋白IIA在吞噬突触的聚集受阻,从而抑制吞噬作用。研究表明,阻断CD47/SHPS1通路可显著增强巨噬细胞对肿瘤细胞的吞噬能力,例如浙江大学团队开发的MAGE系统通过RNA编辑技术敲低巨噬细胞SIRPα(SHPS1),成功解除“别吃我”信号,促进抗肿瘤免疫。
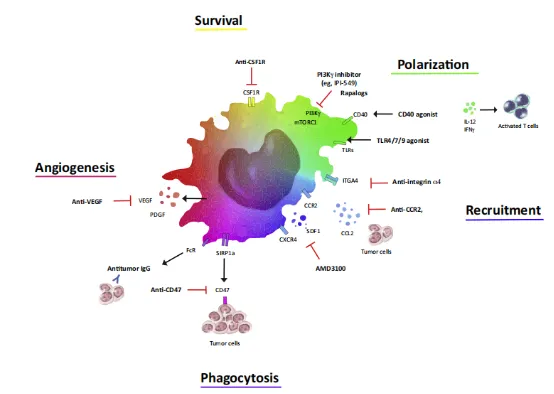
- 调控肿瘤微环境中的免疫抑制
SHPS1不仅影响吞噬作用,还通过调控TAMs(肿瘤相关巨噬细胞)的极化状态参与免疫抑制。例如,SHP-1(与SHPS1结合的下游分子)通过抑制HOXA10和TGFβ2信号,降低肝癌细胞迁移相关蛋白MMP2/9的表达,同时抑制巨噬细胞M2极化。M2型TAMs分泌IL-10、VEGF等因子,促进血管生成并抑制T细胞活性,与患者不良预后密切相关。
- 与检查点抑制剂的协同作用
临床前研究表明,靶向SHPS1/CD47通路可与PD-1/PD-L1抑制剂产生协同效应。例如,抑制CD47可增强巨噬细胞的抗原呈递能力,激活CD8+ T细胞;同时阻断PD-1则进一步解除T细胞的功能抑制,形成“双重免疫激活”。目前多项针对CD47/SHPS1的单抗或小分子抑制剂(如Magrolimab)已进入临床试验阶段。
三、靶向SHPS1的治疗策略与挑战
- 抗体与抑制剂开发
- CD47单抗:通过阻断CD47与SHPS1的结合,解除吞噬抑制。例如,IBI188(抗CD47单抗)在血液瘤和实体瘤中显示出潜力,但需注意其对红细胞的毒性。
- SHP-1/SHP-2抑制剂:蒋琳加团队发现抑制SHP-1可通过代谢重编程逆转白血病干细胞的免疫逃逸,增强化疗敏感性。SHP2变构抑制剂SHP099则通过抑制RAS通路直接杀伤肿瘤,并减少免疫抑制性髓系细胞。
- 基因编辑与细胞疗法
- CAR-巨噬细胞:通过基因工程改造巨噬细胞,使其表达靶向肿瘤抗原的嵌合受体(CAR),同时敲除SHPS1或过表达促吞噬信号分子,可突破肿瘤微环境的抑制。
- RNA递送系统:如浙江大学开发的MAGE系统,利用纳米载体靶向递送CasRx RNA编辑器至巨噬细胞,特异性敲低SIRPα,显著增强抗肿瘤效果。
- 联合治疗与代谢调控
肿瘤微环境中的代谢产物(如乳酸)可促进TAMs的M2极化,而SHPS1信号可能通过mTOR等通路参与代谢调控。联合使用PI3Kγ抑制剂(如IPI-549)与SHPS1靶向药物,可同时逆转免疫抑制和代谢异常,增强疗效。
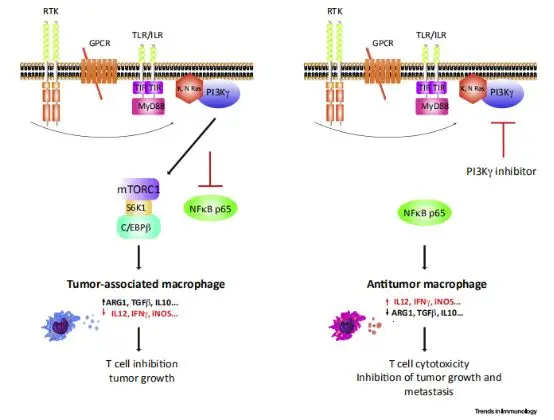
四、未来展望
尽管靶向SHPS1的策略前景广阔,但仍面临以下挑战:
- 毒性管:CD47广泛表达于正常细胞,需优化药物设计以减少贫血等副作用。
- 耐药机制:部分肿瘤可能通过上调其他免疫检查点(如PD-L1)或招募替代性抑制细胞(如MDSCs)产生耐药。
- 个体化治疗:不同肿瘤类型中SHPS1通路的异质性需通过生物标志物(如CD47表达水平)筛选受益人群。
结语
SHPS1作为连接先天免疫与肿瘤微环境的关键分子,其调控机制为癌症治疗提供了全新视角。从阻断“别吃我”信号到重编程巨噬细胞代谢,多维度干预策略正在改写肿瘤免疫治疗的格局。随着基础研究的深入与临床转化的加速,未来或将迎来基于SHPS1靶点的突破性疗法,为患者带来更长生存获益。













