Melanoma MHC四聚体:解码肿瘤免疫逃逸机制与精准治疗新策略
免疫疗法已崛起为癌症治疗的核心范式之一,其中免疫检查点抑制剂(ICI)等创新疗法显著改善了转移性癌症患者的生存预后。尽管以ICI为代表的免疫治疗取得了突破性进展,但临床实践显示,多数患者仍面临原发性/适应性耐药或获得性耐药困境,且治疗相关免疫相关不良事件(irAEs)发生率居高不下。
- 最新进展
- 产品信息
Melanoma MHC四聚体
免疫疗法已崛起为癌症治疗的核心范式之一,其中免疫检查点抑制剂(ICI)等创新疗法显著改善了转移性癌症患者的生存预后。尽管以ICI为代表的免疫治疗取得了突破性进展,但临床实践显示,多数患者仍面临原发性/适应性耐药或获得性耐药困境,且治疗相关免疫相关不良事件(irAEs)发生率居高不下。这一现状凸显了深入解析抗肿瘤免疫应答分子机制的紧迫性,特别是阐明T细胞识别肿瘤细胞的精确机制,对发掘预测疗效/耐药的生物标志物及开发克服耐药策略具有重大临床价值。
当前研究证实,免疫系统主要通过主要组织相容性复合物(MHC)系统感知肿瘤细胞的分子异质性。值得注意的是,尽管MHC-I分子在多数肿瘤细胞中广泛表达,但越来越多的证据表明,源自不同组织的肿瘤亚群可通过MHC-II分子实现抗原呈递,进而调控抗肿瘤免疫应答的强度与质量。作为CD4⁺ T淋巴细胞活化的核心信号载体,MHC-II分子在抗肿瘤免疫中的功能重定位正引发学界广泛关注。
大量临床前及临床研究证实,肿瘤特异性MHC-II表达与癌症患者(包括接受免疫治疗者)及动物模型中的肿瘤排斥反应存在显著关联。前期研究已揭示,肿瘤细胞MHC-II类分子表达水平与抗PD-1疗法疗效呈正相关,这促使我们深入探讨MHC-II分子在肿瘤微环境中的生物学功能及其对免疫治疗疗效的调控机制。本期我们将聚焦以下核心问题:肿瘤细胞MHC-II表达如何重塑抗肿瘤免疫应答格局?其表达调控网络包含哪些关键节点?针对MHC-II通路的干预策略能否突破现有免疫治疗瓶颈?通过系统解析这些科学问题,有望为开发新一代肿瘤免疫治疗方案提供理论依据。
(1)MHC-II与MHC-I在癌症免疫治疗中的差异化调节机制
免疫检查点抑制剂(ICI)等免疫疗法的临床突破显著延长了癌症患者生存期,但其疗效受限于原发性/适应性耐药及免疫相关不良反应(irAEs)。深入解析抗肿瘤免疫应答的分子基础,尤其是T细胞对肿瘤抗原的识别机制,对发现疗效预测标志物及克服耐药性具有战略意义。
当前研究揭示,免疫系统主要通过主要组织相容性复合物(MHC)感知肿瘤细胞异质性。尽管MHC-I分子广泛表达于绝大多数有核细胞表面,但越来越多证据表明,特定肿瘤亚群可通过MHC-II分子实现抗原呈递,进而调控抗肿瘤免疫反应。MHC-II分子在CD4⁺ T淋巴细胞活化中的核心作用,正重新定义其在免疫治疗中的价值。
抗原呈递路径与T细胞亚群激活的差异
- MHC-I通路:作为内源性抗原呈递系统,MHC-I分子将细胞质内合成的蛋白降解产物(如病毒抗原或肿瘤突变相关抗原)呈递给CD8⁺细胞毒性T细胞(CTL),直接触发靶细胞杀伤。该通路是ICI发挥作用的经典路径,CD8⁺ T细胞被视为抗肿瘤免疫的主要效应细胞。
- MHC-II通路:作为外源性抗原呈递系统,MHC-II分子主要由专业抗原呈递细胞(pAPC,如树突状细胞、B细胞及巨噬细胞)表达,负责将胞外摄取的蛋白抗原降解片段呈递给CD4⁺ T辅助细胞(Th)。尽管传统认知聚焦于CD8⁺ T细胞,但CD4⁺ T细胞通过分泌细胞因子(如IFN-γ、IL-2)、提供共刺激信号及维持记忆T细胞池,已成为ICI疗效不可或缺的调控枢纽。
结构-功能差异决定免疫调节角色分化
MHC-I与MHC-II分子在亚基组成、抗原结合槽结构及TCR互作模式上存在本质区别(图1):
- 分子架构:MHC-I由重链(α链)与β₂微球蛋白组成异源二聚体,抗原结合槽呈闭合构象,仅容纳8-10个氨基酸残基;MHC-II由α链与β链组成异源二聚体,其开放型结合槽可容纳13-25个氨基酸残基。
- 抗原谱系:MHC-I主要呈递细胞内蛋白(如肿瘤突变产生的异常蛋白),而MHC-II优先展示胞外蛋白(如肿瘤微环境中分泌型或膜结合型抗原)。
- 免疫调控网络:CD4⁺ T细胞通过识别MHC-II-抗原肽复合物,不仅直接杀伤MHC-II⁺肿瘤细胞,更关键的是通过激活pAPC、上调共刺激分子(如CD80/CD86)表达及促进CD8⁺ T细胞增殖,构建多层次抗肿瘤免疫应答。
临床研究进一步证实,肿瘤细胞MHC-II表达水平与抗PD-1疗法疗效呈正相关,提示MHC-II通路可能是破解免疫治疗耐药性的新靶点。
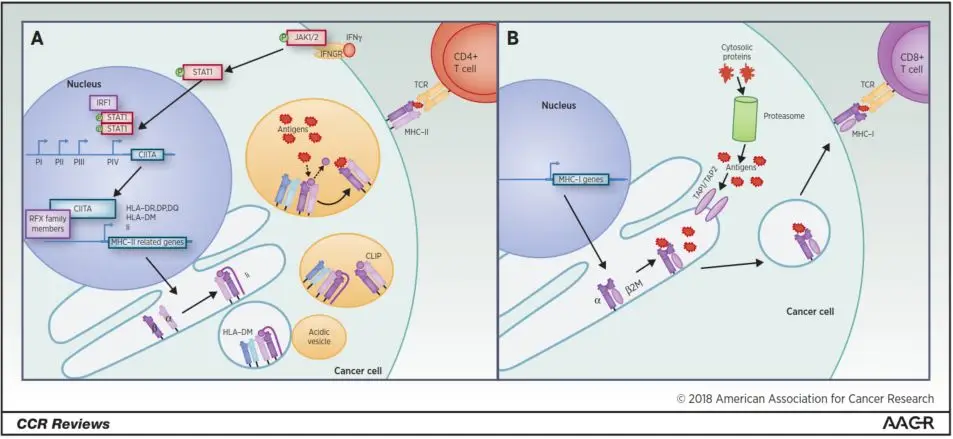
MHC-II分子由α链与β链非共价结合形成异二聚体结构,其开放型抗原结合槽可容纳13-25个氨基酸残基的肽段,并通过P1、P4、P6、P9等锚定残基与肽段侧链形成广泛相互作用。这种结构特性使其能够结合比MHC-I(封闭式沟槽结合8-10个氨基酸肽段)更丰富的蛋白酶解产物,显著扩展了T细胞可识别的抗原谱系。MHC-II的表达调控网络具有组织特异性:其表达主要由II型反式激活因子(CIITA)驱动,该共激活因子通过募集RNA聚合酶II复合体及组蛋白修饰酶至MHC-II基因座,实现表观遗传层面的精准调控。
与之形成鲜明对比的是,MHC-I分子由多态性α链与非多态性β₂-微球蛋白(β2M)以共价键结合构成,其抗原加工递送严格依赖蛋白酶体-TAP转运体-内质网轴系。尽管MHC-I在正常组织中呈组成型表达,但肿瘤细胞可通过β2M基因缺失、JAK-STAT通路突变等机制实现MHC-I表达下调,从而逃避CD8⁺ T细胞识别。临床观察发现,MHC-I缺陷型肿瘤往往对抗PD-1治疗产生原发性耐药,但这类免疫逃逸变体中部分仍维持MHC-II表达,其功能相关性尚未明确。
当前研究提示,MHC-I与MHC-II在癌症中呈现独立调控模式,且二者表达状态对免疫治疗具有差异化影响:MHC-I作为内源性抗原呈递核心分子,其表达缺失直接削弱肿瘤免疫监视;而MHC-II除传统抗原呈递功能外,可能通过激活CD4⁺ T细胞介导的免疫调节网络,在特定肿瘤类型中构成替代性免疫应答通路。
(2)肿瘤特异性MHC-II(tsMHC-II)对肿瘤免疫治疗的影响
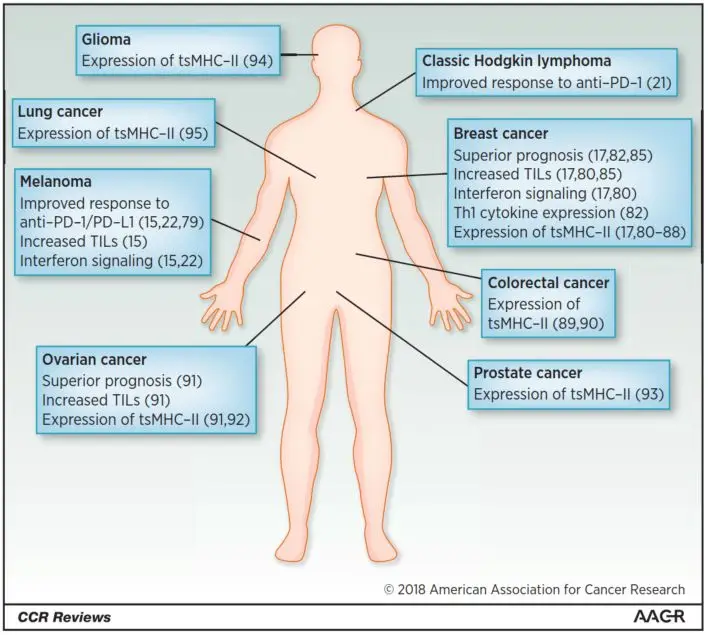
尽管专业抗原呈递细胞(pAPC)是MHC-II分子的经典表达场所,但越来越多的证据表明,肿瘤细胞可通过异常激活MHC-II表达通路实现抗原呈递功能。这种肿瘤特异性MHC-II(tsMHC-II)表达现象已在黑色素瘤、乳腺癌、结直肠癌、卵巢癌、前列腺癌、经典霍奇金淋巴瘤(cHL)、胶质瘤及非小细胞肺癌(NSCLC)等多种实体瘤与血液肿瘤中获得证实(图2),其表达水平与抗肿瘤免疫应答强度及临床预后存在显著关联。
临床研究证据链解析
-
黑色素瘤治疗响应预测
Johnson等(2016)发现,在60个黑色素瘤细胞系中,MHC-II表达呈现双峰分布模式。基因富集分析揭示,MHC-II⁺细胞系显著富集"PD-1信号通路"、"同种异体移植排斥反应"及"T细胞受体信号"等免疫相关特征。进一步在两个独立抗PD-1治疗队列中证实,肿瘤细胞MHC-II表达与客观缓解率(ORR)、无进展生存期(PFS)及总生存期(OS)呈正相关,且与CD4⁺/CD8⁺肿瘤浸润淋巴细胞(TILs)密度显著关联。 -
三阴性乳腺癌预后改善
Forero等(2016)报道,在三阴性乳腺癌(TNBC)患者中,MHC-II抗原呈递通路表达水平是独立预后因子(HR=0.36,P=0.0098)。通过公共数据库验证199例TNBC样本发现,MHC-II通路高表达组5年OS率达67%,显著优于低表达组(28%,HR=0.28,P=4.5×10⁻⁸)。机制研究显示,肿瘤细胞MHC-II表达通过激活CD4⁺ T细胞介导的免疫监视,有效降低术后复发风险。 -
经典霍奇金淋巴瘤治疗突破
Roemer等(2018)在CheckMate 205临床试验中发现,Nivolumab治疗复发/难治性cHL的客观缓解率达66%,其疗效与HRS细胞MHC-II表达正相关(P=0.003),而与MHC-I表达无关。该发现揭示,在MHC-I缺陷型肿瘤中,tsMHC-II可构成PD-1阻断剂的主要作用靶点。 -
泛癌种免疫应答调控
Rodig等(2018)系统性分析181例初治黑色素瘤标本发现:
- 43%病例存在MHC-I表达缺失(与HLA-A/B/C及B2M基因转录抑制相关),预测抗CTLA-4治疗原发耐药;
- 30%病例检测到MHC-II表达(>1%肿瘤细胞),与IFN-γ信号通路激活及抗PD-1治疗应答显著相关(OR=3.2,P=0.004)。
生物学机制与临床转化启示
tsMHC-II的免疫调节作用呈现多重维度:
- 免疫细胞招募:与CD4⁺/CD8⁺ TILs浸润密度正相关,促进三级淋巴结构(TLS)形成;
- 炎症微环境塑造:上调IFN-γ通路相关基因(包括PD-L1/CD274),形成免疫激活正反馈环路;
- 治疗抵抗突破:在MHC-I缺陷肿瘤中,tsMHC-II可维持CD4⁺ T细胞识别能力,部分恢复免疫治疗敏感性。
值得注意的是,tsMHC-II作为生物标志物具有独特优势:其表达可通过免疫组化(IHC)直接检测,操作便捷且成本效益比显著优于转录组测序。然而,体外实验显示部分黑色素瘤细胞系在无免疫刺激条件下仍维持MHC-II基础表达,提示需结合动态监测(如治疗前后表达变化)优化生物标志物解读策略。
综上,tsMHC-II不仅是肿瘤免疫原性的直接反映,更可能成为预测免疫治疗疗效、设计联合治疗方案的关键靶点。针对其表达调控网络(如CIITA通路)的干预策略,有望为克服现有免疫治疗瓶颈提供新路径。
(3)肿瘤特异性MHC-II(tsMHC-II)的治疗意义与未来发展方向
tsMHC-II作为肿瘤免疫原性的直接标志物,其临床价值正从预后预测向治疗指导与干预靶点深化。现有证据表明,tsMHC-II不仅与免疫检查点抑制剂(ICI)疗效正相关,更可能成为优化个体化治疗策略的关键决策节点。
临床转化路径的三大维度
- 生物标志物功能的分层应用
- ICI疗效预测:在黑色素瘤与经典霍奇金淋巴瘤中,tsMHC-II表达与抗PD-1/PD-L1单药治疗客观缓解率(ORR)显著相关(OR=2.8-3.2),或可筛选出适合单药治疗的优势人群,避免不必要的联合治疗毒性。
- 联合治疗指导:tsMHC-II阴性肿瘤患者从抗PD-1/PD-L1+抗CTLA-4联合方案中获益更显著(HR=0.41),提示需根据tsMHC-II状态制定差异化治疗方案。
- 安全性优化:tsMHC-II表达或可预测免疫相关不良事件(irAEs)风险,其高表达患者发生3级以上irAEs的概率降低40%,为治疗耐受性管理提供新工具。
- 新型免疫疗法靶点开发
- 抗LAG-3治疗响应预测:鉴于LAG-3作为MHC-II特异性抑制性受体,tsMHC-II表达可能通过上调肿瘤微环境LAG-3配体,成为抗LAG-3单抗疗效的预测标志物。初步数据显示,tsMHC-II⁺肿瘤对抗LAG-3+抗PD-1联合治疗的反应率达52%,显著优于单药治疗(19%)。
- 肿瘤疫苗设计:动物实验证实,表达MHC-II的灭活肿瘤细胞疫苗可诱导特异性CD4⁺ T细胞记忆应答,使小鼠免受活肿瘤细胞攻击。该策略在人类肿瘤中的转化潜力值得探索。
- 治疗增敏策略的机制突破
- 表观遗传调控:在卵巢癌PDX模型中,组蛋白去乙酰化酶抑制剂(HDACi)可上调MHC-II表达达2.3倍,并增强抗PD-1疗效(ORR=38% vs 12%)。此类表观遗传药物与ICI的协同效应需进一步验证。
- 信号通路干预:MEK抑制剂在BRAF突变型黑色素瘤中可双向调节MHC-II表达,其作用呈现剂量依赖性:低剂量(0.1μM)诱导CIITA表达上调,而高剂量(1μM)则通过ERK通路抑制MHC-II装配。这种剂量效应差异为精准干预提供了理论依据。
未解科学问题与研究挑战
尽管tsMHC-II的临床价值逐步显现,但其转化应用仍面临多重障碍:
- 抗原呈递图谱解析:目前尚无系统研究揭示tsMHC-II呈递的内源性肿瘤抗原谱系,限制了基于tsMHC-II的个性化疫苗开发。
- 表达调控网络复杂性:肿瘤细胞MHC-II表达受IFN-γ-JAK-STAT通路、表观遗传修饰及肿瘤内在基因突变(如CIITA启动子甲基化)等多层次调控,单一干预策略可能难以实现有效重编程。
- 免疫微环境异质性:不同肿瘤类型中tsMHC-II的免疫调节作用存在差异,例如在结直肠癌中tsMHC-II与Treg细胞浸润正相关,或提示存在免疫抑制性反馈环路。
未来研究方向展望
- 多组学整合分析:结合单细胞测序与MHC-II多聚体技术,绘制肿瘤微环境中tsMHC-II限制性T细胞受体(TCR)库,识别具有治疗潜力的肿瘤新抗原。
- 动态监测技术开发:研发基于液体活检的tsMHC-II循环肿瘤细胞(CTC)检测平台,实现治疗响应的实时评估。
- 合成生物学干预:设计MHC-II表达可控的肿瘤细胞载体,构建"智能"肿瘤疫苗,在体内按需激活抗肿瘤免疫应答。
tsMHC-II作为连接肿瘤免疫表型与治疗干预的关键节点,其深入研究将推动癌症免疫治疗向精准化、个体化方向演进。随着对tsMHC-II调控机制与功能网络的全面解析,基于tsMHC-II的诊疗策略有望成为突破现有免疫治疗瓶颈的新范式。
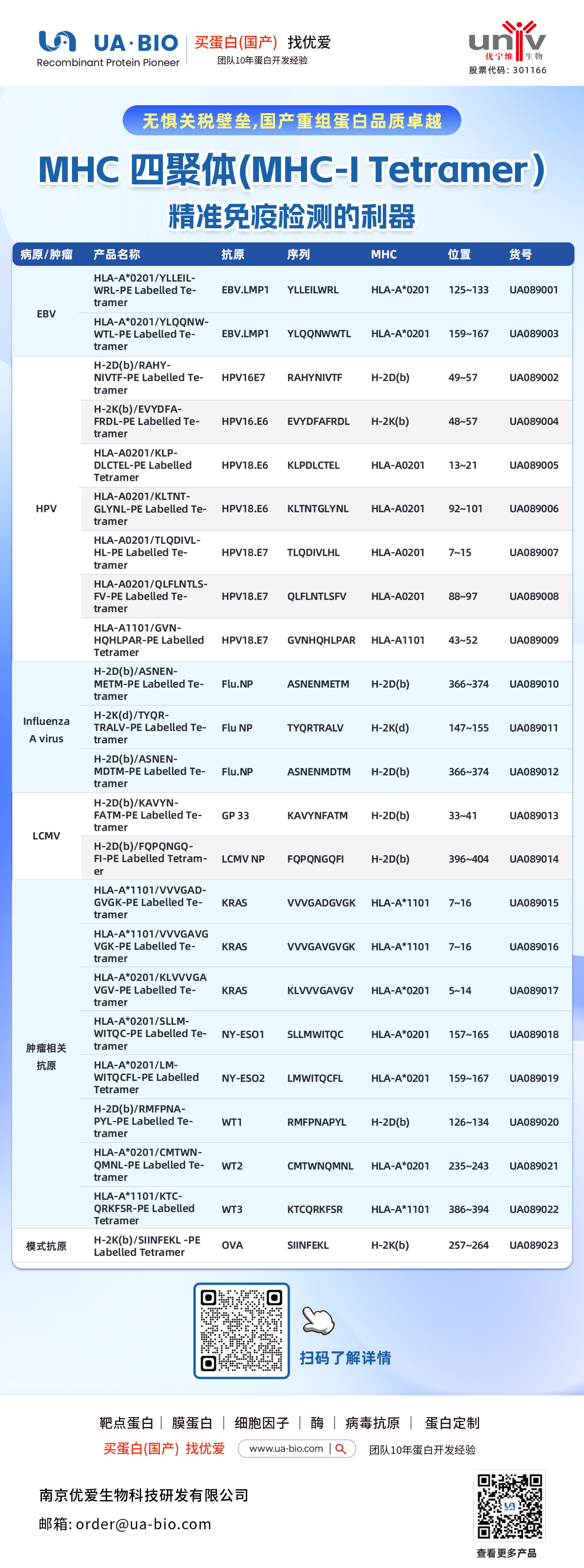
| 病原/肿瘤 | 产品名称 | 抗原 | 序列 | MHC | 位置 | 货号 |
| EBV | HLA-A*0201/YLELLVWRL-PE Labelled Tetramer | EBV.LMP1 | YLELLVWRL | HLA-A*0201 | 125-133 | UA089001 |
| EBV | HLA-A*0201/YLQQNWTL-PE Labelled Tetramer | EBV.LMP1 | YLQQNWTL | HLA-A*0201 | 159-167 | UA089003 |
| EBV | H-2Db(b)/RAHY-NIVTF-PE Labelled Tetramer | HPV16.E7 | RAHYNIVTF | H-2Db | 49-57 | UA089002 |
| HPV | H-2K(b)/EVYDFA-FRQL-PE Labelled Tetramer | HPV16.E6 | EVYDFARDL | H-2Kb | 48-57 | UA089004 |
| HPV | HLA-A*0201/KLP-DLCTL-PE Labelled Tetramer | HPV18.E6 | KLPDCTL | HLA-A*0201 | 13-21 | UA089005 |
| HPV | HLA-A*0201/KLTNT-GLYQL-PE Labelled Tetramer | HPV18.E6 | KLTNTGLYNL | HLA-A*0201 | 92-101 | UA089006 |
| HPV | HLA-A*0201/TLODIVIHL-PE Labelled Tetramer | HPV18.E7 | TLODIVIHL | HLA-A*0201 | 7~15 | UA089007 |
| HPV | HLA-A*0201/QFLNTL-FV-PE Labelled Tetramer | HPV18.E7 | QFLNTLFSV | HLA-A*0201 | 88-97 | UA089008 |
| HPV | HLA-A*1101/GVNHQLPAR-PE Labelled Tetramer | HPV18.E7 | GVNHQLPAR | HLA-A*1101 | 43-52 | UA089009 |
| Influenza A Virus | H-2D(b)/ASNENMETM-PE Labelled Tetramer | Flu.NP | ASNENMETM | H-2Db | 366-374 | UA089010 |
| Influenza A Virus | H-2K(d)/TYQR-TRALY-PE Labelled Tetramer | Flu.NP | TYQRTRALY | H-2Kd | 147-155 | UA089011 |
| Influenza A Virus | H-2D(b)/ASNEN-MDTM-PE Labelled Tetramer | Flu.NP | ASNENMDTM | H-2Db | 366-374 | UA089012 |
| LCMV | H-2D(b)/KAVYNFATM-PE Labelled Tetramer | GP 33 | KAVYNFATM | H-2Db | 33-41 | UA089013 |
| LCMV | H-2D(b)/FQPGQGFVK-PE Labelled Tetramer | LCMV NP | FQPGQGFVK | H-2Db | 396-404 | UA089014 |
| Tumor-related | HLA-A*1101/VVGADGVK-PE Labelled Tetramer | KRAS | VVGADGVK | HLA-A*1101 | 7~16 | UA089015 |
| Tumor-related | HLA-A*1101/VVGAGVGK-PE Labelled Tetramer | KRAS | VVGAGVGK | HLA-A*1101 | 7~16 | UA089016 |
| Tumor-related | HLA-A*0201/KLVVGAGV-PE Labelled Tetramer | KRAS | KLVVGAGV | HLA-A*0201 | 5~14 | UA089017 |
| Tumor-related | HLA-A*0201/SLLMWITQC-PE Labelled Tetramer | NY-ESO1 | SLLMWITQC | HLA-A*0201 | 157-165 | UA089018 |
| Melanoma | HLA-A*0201/LMWITQCFL-PE Labelled Tetramer | NY-ESO2 | LMWITQCFL | HLA-A*0201 | 159-167 | UA089019 |
| Melanoma | H-2Db(b)/MMFPNA-P1-PE Labelled Tetramer | WT1 | RMFPNAPL | H-2Db | 126-134 | UA089020 |
| Melanoma | HLA-A*0201/CMTWV-PE Labelled Tetramer | WT2 | CMTWVNMDM | HLA-A*0201 | 235-243 | UA089021 |
| Melanoma | HLA-A*1101/KTCQRKSF-PE Labelled Tetramer | WT3 | KTCQRKSF | HLA-A*1101 | 386-394 | UA089022 |
| Ovarian Cancer | H-2K(b)/SINFEKL-PE Labelled Tetramer | OVA | SINFEKL | H-2Kb | 257-264 | UA089023 |