- 最新进展
- 产品信息
最新进展
促红细胞生成素(EPO):癌症免疫治疗中的“隐藏推手”
在癌症治疗的战场上,免疫治疗曾经被视为一种革命性的突破,尤其是针对PD-1/PD-L1通路的检查点抑制剂,为许多患者带来了希望。然而,临床实践发现,这种治疗对大多数患者的效果并不理想,尤其是那些所谓的“冷肿瘤”患者。冷肿瘤就像免疫系统的“黑洞”,其中缺乏能够有效攻击肿瘤的T细胞,而充满了抑制免疫反应的细胞。最近,斯坦福大学Engleman团队的一项研究揭示了一个令人惊讶的发现:肿瘤细胞分泌的促红细胞生成素(EPO)可能是冷肿瘤免疫抑制的关键因素。
一、EPO:从贫血治疗到癌症免疫的“暗黑面”
促红细胞生成素(EPO)是一种由肾脏分泌的激素,主要功能是刺激骨髓生成红细胞。临床上,重组人EPO被广泛用于治疗贫血,尤其是在化疗或慢性肾病患者中。然而,过去的研究发现,肿瘤患者在接受外源性EPO治疗后,生存期可能会缩短。这一现象一直困扰着科学家,直到最近的研究揭示了EPO在肿瘤免疫中的“暗黑面”。
二、EPO与冷肿瘤的直接关联
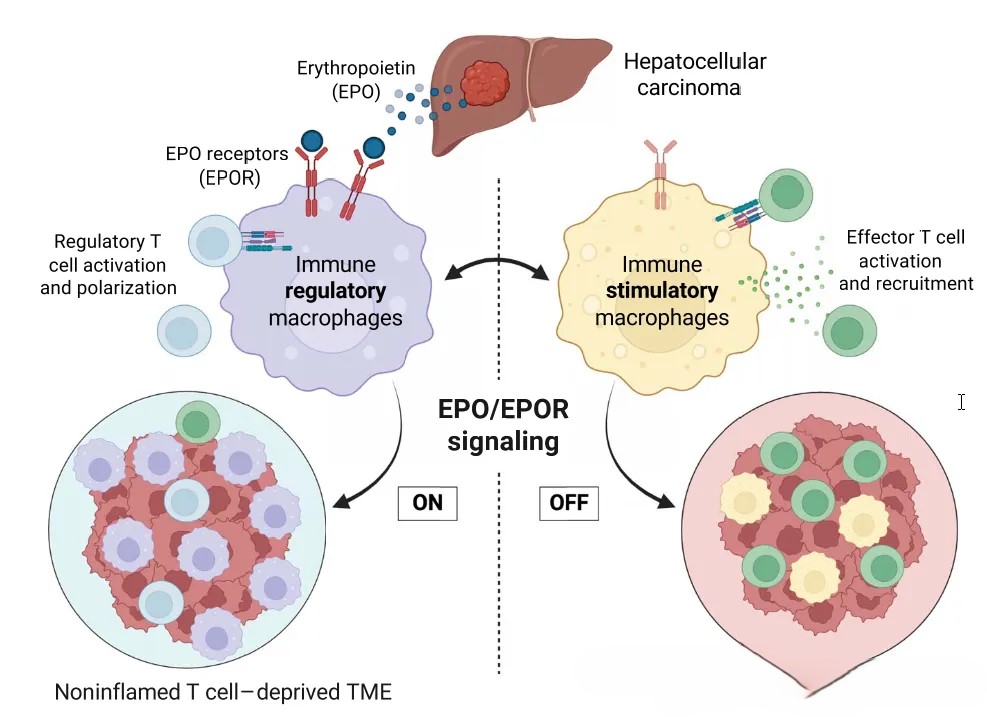
Engleman团队通过基因编辑构建了两种自发性肝癌小鼠模型:一种是T细胞富集的“热肿瘤”,另一种是T细胞缺失的“冷肿瘤”。研究发现,冷肿瘤模型中血浆EPO水平显著升高,且这种升高与贫血无关。进一步的临床数据证实,肝癌组织中EPO高表达的患者总体生存率更低,且肿瘤分化更差、血管侵犯更常见。这些发现表明,肿瘤细胞自身分泌的EPO可能是冷肿瘤免疫抑制的“幕后推手”。
三、EPO如何屏蔽T细胞的攻击?
EPO的传统受体(EPOR)被认为主要表达于红系祖细胞。然而,近年来的研究发现,EPOR也存在于巨噬细胞、内皮细胞甚至神经元中。Engleman团队的研究发现,冷肿瘤中的巨噬细胞高表达EPOR,而热肿瘤则不表达。肿瘤源性的EPO通过结合巨噬细胞的EPOR,改变了巨噬细胞的功能状态,阻止其分化为促炎性表型,反而驱动其向免疫抑制表型转化。
进一步的机制研究表明,EPO激活了NRF2通路,导致巨噬细胞内铁元素的大量消耗,使细胞无法向T细胞递呈抗原,同时分泌抑制性细胞因子(如IL-10、TGF-β)。此外,EPO激活的巨噬细胞还诱导调节性T细胞(Treg)扩增,形成免疫抑制网络。简而言之,肿瘤通过分泌EPO,将巨噬细胞“洗脑”为免疫系统的“叛徒”,使肿瘤微环境变成T细胞的“荒漠”。
四、阻断EPO信号如何逆转冷肿瘤?
Engleman团队通过基因敲除实验验证了EPO/EPOR轴的核心作用。研究发现,敲除肿瘤细胞中的EPO或巨噬细胞的EPOR,可以使冷肿瘤变为热肿瘤,显著增加T细胞浸润,抑制肿瘤生长,延长小鼠存活期。此外,通过siRNA靶向敲低EPOR的表达或使用NRF2抑制剂处理,能够有效逆转巨噬细胞的免疫抑制表型。更令人鼓舞的是,阻断EPO信号后,原本对PD-1抑制剂无反应的冷肿瘤,展现出显著的协同治疗效果。
五、EPO作为治疗靶点的潜力与挑战
Engleman团队的研究不仅揭示了EPO在肿瘤免疫逃逸中的核心作用,还为逆转免疫抑制提供了全新的靶点。分析发现,EPO高表达与多种实体瘤(如胰腺癌、肺癌、乳腺癌)的不良预后相关。这提示EPO/EPOR抑制剂可能成为一种通用型免疫治疗药物,尤其适用于冷肿瘤患者。然而,现有抗贫血药物(如重组EPO)在癌症患者中的使用需要谨慎评估风险。
针对EPO/EPOR轴的潜在疗法包括单克隆抗体、小分子抑制剂以及联合用药。单克隆抗体可以靶向肿瘤来源的EPO或巨噬细胞EPOR,而小分子抑制剂可以阻断EPOR下游信号(如NRF2通路)。联合用药则可以与PD-1抑制剂联用,破解双重免疫抑制机制。
六、结语
Engleman团队的研究首次揭示了EPO在肿瘤免疫逃逸中的核心作用,不仅解答了冷肿瘤形成的关键机制,还为逆转免疫抑制提供了全新靶点。未来,通过精准干预EPO/EPOR轴,我们有望将“冷”肿瘤转化为“热”肿瘤,让更多患者受益于免疫治疗。正如研究者所言:“免疫治疗不应只依赖T细胞本身的活性,重塑肿瘤微环境可能才是开启治愈之门的关键钥匙。”
产品信息













