- 最新进展
- 产品信息
GM-CSF中和策略:免疫治疗毒性调控的前沿探索
粒细胞-巨噬细胞集落刺激因子(GM-CSF)作为髓系细胞增殖与分化的关键调控因子,在免疫应答中扮演双重角色:一方面促进中性粒细胞与巨噬细胞的成熟,增强机体抗感染能力;另一方面,其过度表达可引发级联式炎症反应,导致细胞因子风暴(CRS)及神经毒性等严重副作用。近年来,GM-CSF中和策略在免疫治疗毒性调控领域展现出显著潜力,成为突破现有疗法安全性瓶颈的重要方向。
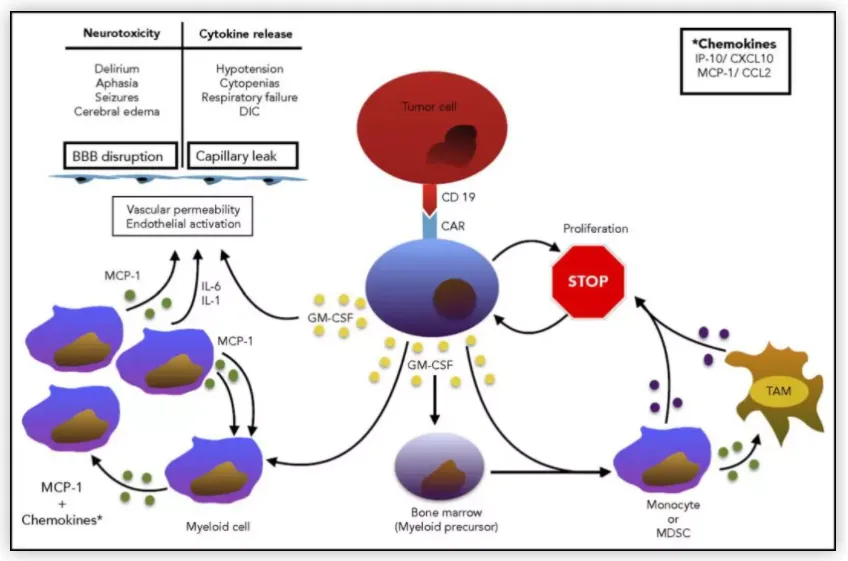
GM-CSF的免疫调控机制与毒性关联
GM-CSF通过与髓系细胞表面受体(GM-CSFR)结合,激活JAK-STAT信号通路,诱导髓系来源抑制细胞(MDSC)和肿瘤相关巨噬细胞(TAM)的增殖与活化。在嵌合抗原受体T细胞(CAR-T)治疗中,GM-CSF的分泌是CRS与神经毒性(NT)的关键上游触发因子。研究表明,CAR-T细胞与肿瘤抗原结合后,可释放GM-CSF等炎性因子,激活髓系细胞产生TNF-α、IL-6等细胞因子,形成正反馈循环,加剧全身性炎症反应。此外,GM-CSF还可直接诱导MDSC和TAM的募集,这些细胞通过分泌免疫抑制性分子(如IDO、Arg-1)抑制T细胞增殖与效应功能,形成“疗效-毒性”悖论:即增强抗肿瘤免疫的同时,也加剧了组织损伤。
GM-CSF中和策略的分子机制与临床转化
GM-CSF中和策略通过阻断GM-CSF/GM-CSFR信号轴,抑制髓系细胞介导的炎症级联反应。抗GM-CSF单克隆抗体可特异性结合GM-CSF,阻断其与受体结合,从而抑制MDSC和TAM的活化与增殖。动物实验显示,GM-CSF中和可显著降低CRS模型动物的血清IL-6水平,减轻肺水肿与肝损伤,同时保留CAR-T细胞的抗肿瘤活性。这一策略的核心优势在于其靶向性:仅干扰GM-CSF介导的髓系细胞激活,而不直接抑制CAR-T细胞的增殖或细胞毒性功能。
技术挑战与优化方向
尽管GM-CSF中和策略展现出显著疗效,但其临床应用仍面临挑战。首先,GM-CSF在生理状态下的免疫调节作用需精准平衡,过度中和可能导致抗感染能力下降。因此,开发具有半衰期调控能力的抗体或基因编辑工具(如CRISPR-Cas9介导的GM-CSF基因敲除)成为关键。其次,GM-CSF中和与其他免疫疗法的协同作用需进一步探索。例如,在CAR-T治疗中联合GM-CSF中和抗体与免疫检查点抑制剂,可能通过重塑肿瘤微环境(TME)中的髓系细胞组成,增强抗肿瘤免疫应答。此外,GM-CSF中和策略在传染病(如COVID-19)中的应用也值得关注:GM-CSF水平与COVID-19患者的急性呼吸窘迫综合征(ARDS)严重程度呈正相关,中和GM-CSF可能成为缓解重症患者肺部炎症的新途径。
未来展望
GM-CSF中和策略为免疫治疗毒性调控提供了新范式。通过精准阻断GM-CSF信号通路,可在不削弱抗肿瘤疗效的前提下,显著降低CRS与神经毒性的发生率。未来研究需聚焦于:①开发长效、低免疫原性的GM-CSF中和抗体或基因编辑工具;②探索GM-CSF中和与其他免疫疗法的联合应用,优化疗效/毒性平衡;③解析GM-CSF在TME中的动态调控机制,为个性化治疗提供依据。随着技术的不断突破,GM-CSF中和策略有望成为下一代免疫治疗的核心组成部分,推动肿瘤与感染性疾病治疗进入“精准调控”时代。













