- 最新进展
- 产品信息
- 参考文献
结直肠癌(Colorectal Cancer, CRC)是全球范围内发病率最高的恶性肿瘤之一。目前,手术切除仍是CRC的主要治疗手段,但化疗及靶向药物的应用显著改善了患者的生存获益。已获批用于CRC治疗的靶向药物主要包括以下几类:
(1)VEGF抑制剂:贝伐珠单抗(Bevacizumab)、阿柏西普(Aflibercept);
(2)VEGFR抑制剂:雷莫芦单抗(Ramucirumab)、瑞戈非尼(Regorafenib)、呋喹替尼(Fruquintinib);
(3)EGFR抑制剂:西妥昔单抗(Cetuximab)、帕尼单抗(Panitumumab);
(4)PD-1/PD-L1抑制剂:帕博利珠单抗(Pembrolizumab)、纳武利尤单抗(Nivolumab);
(5)CTLA-4抑制剂:伊匹木单抗(Ipilimumab);
(6)BRAF抑制剂:维莫非尼(Vemurafenib)。
CRC的分子异质性与现有治疗的局限性
研究表明,CRC是一种由多基因突变驱动的分子异质性疾病,常见突变基因包括KRAS、BRAF、PIK3CA、TP53、APC、CTNNB1、SMAD4、TGFBR2、SOX9及ERBB2等,这些突变导致Wnt/β-catenin、RAS-RAF-MEK-ERK(MAPK)、TGFβ及PI3K-AKT等信号通路异常激活,促进肿瘤进展。然而,现有靶向治疗仍存在显著局限性,例如:
抗EGFR治疗对KRAS突变患者无效;PD-1/PD-L1抑制剂仅适用于微卫星高度不稳定(MSI-H)/错配修复缺陷(dMMR)患者,而微卫星稳定(MSS)型占晚期CRC的95%,对免疫治疗响应不佳。
近期CRC治疗进展
近年来,多项研究探索了新型联合治疗策略:
1、瑞戈非尼联合纳武利尤单抗:一项日本临床试验显示,在24例MSS型转移性CRC(mCRC)患者中,采用剂量递增模式(80~120 mg),客观缓解率(ORR)达33%(8/24),且缓解者均为男性,多伴肺转移(>70%合并淋巴结转移)。
2、BRAF/MEK/EGFR三联疗法:Array公司(现属辉瑞)开发的Encorafenib(BRAF抑制剂)、Binimetinib(MEK抑制剂)联合西妥昔单抗,在BRAF V600E突变mCRC的III期临床试验中,相较于化疗组显著改善总生存期(OS)、无进展生存期(PFS)及ORR。
GUCY2C-CD3双特异性抗体的潜力
2020年,辉瑞在Clinical Cancer Research发表研究,报道了其开发的GUCY2C-CD3双特异性抗体PF-07062119。该药物通过靶向GUCY2C(肿瘤)和CD3(T细胞),诱导T细胞介导的肿瘤杀伤。
结构与机制
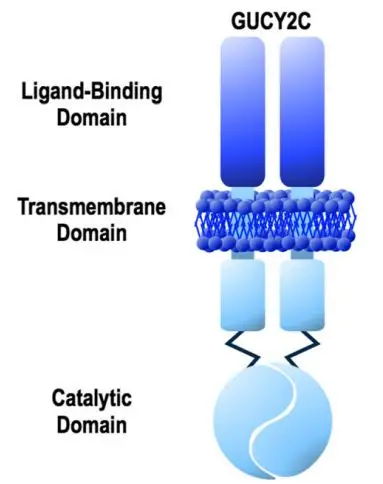
PF-07062119为全人源化双抗,由靶向GUCY2C和CD3ε的单链抗体片段(scFv)与IgG1 Fc融合而成(图1)。通过CH2区突变降低FcγR结合活性,并采用“杵臼结构”(Knobs-into-Holes, KiH)技术促进异源二聚体形成,延长半衰期。
图1 PF-07062119结构示意图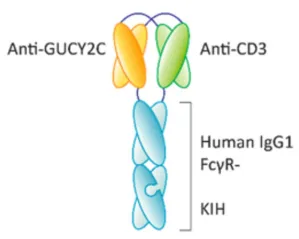
临床前数据
1、体外实验:
流式细胞术证实PF-07062119特异性结合GUCY2C阳性肿瘤细胞(如HCT116-hGUCY2C),且不结合GUCY2C阴性细胞。
在CRC细胞系中,该药物展现纳摩尔级T细胞依赖性细胞毒性,且细胞杀伤效率与GUCY2C表达水平及剂量呈正相关(图2)。
值得注意的是,PF-07062119不影响GUCY2C信号通路功能,避免了对肠道稳态的干扰。
图2 PF-07062119介导的体外细胞毒性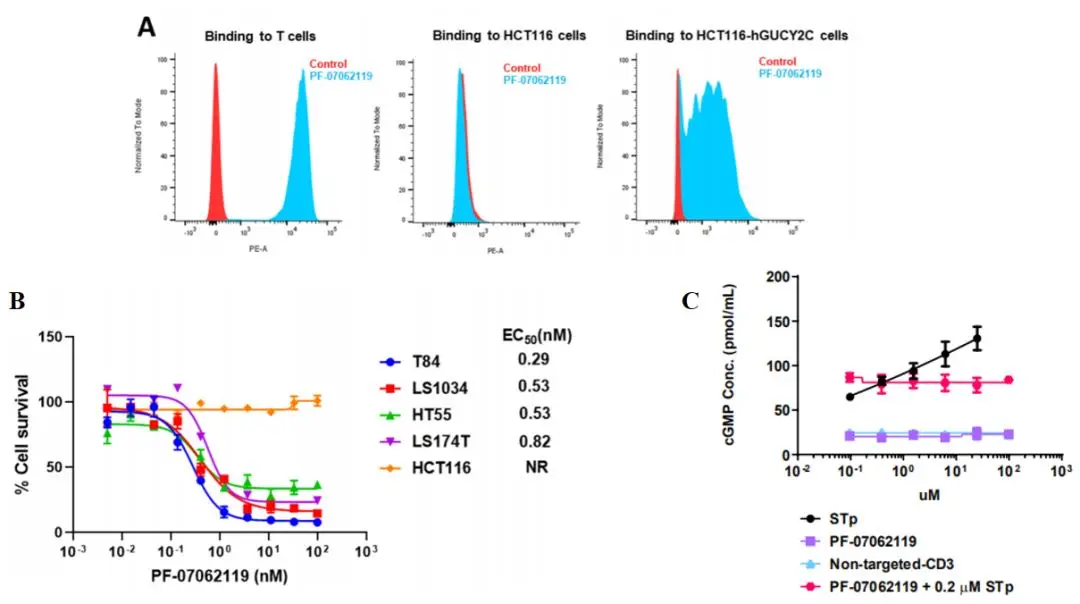
2、体内实验:
在多种人源肿瘤异种移植模型(包括KRAS/BRAF突变型)中,PF-07062119表现出显著抗肿瘤活性:
GUCY2C高表达模型:0.1~0.15 mg/kg即可完全抑制肿瘤生长;
GUCY2C低表达模型:1.0 mg/kg时仍显示中度抑制效果。
在LS1034原位模型中,0.3 mg/kg剂量下肿瘤完全消退,且未见转移;更高剂量时虽出现肝转移,但总体表明该药物可抑制CRC扩散(图3)。
表1 结直肠癌异种移植模型特征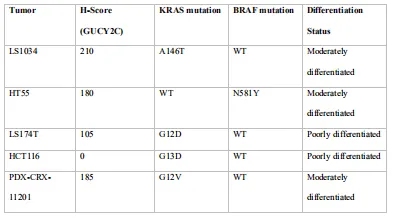
图3 PF-07062119在多模型中的抗肿瘤效果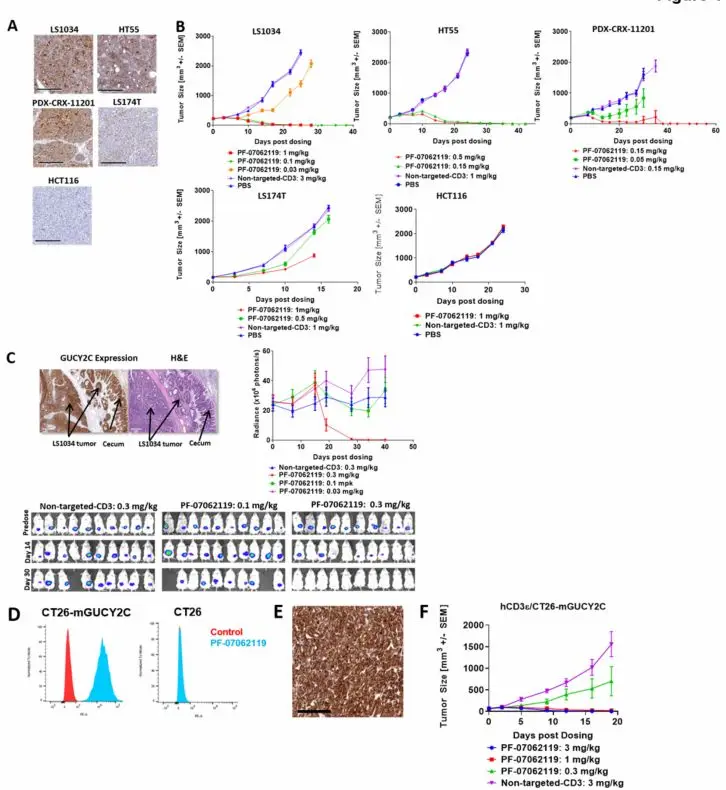
3、免疫微环境调控:
PF-07062119可剂量依赖性促进肿瘤浸润淋巴细胞(TILs)聚集,并形成免疫突触,增强细胞毒性。
但该药物会上调肿瘤PD-L1表达,可能限制T细胞活性。联合PD-1/PD-L1抑制剂可显著增强疗效(图4)。
图4 PF-07062119联合免疫检查点抑制剂的协同效应
(图片)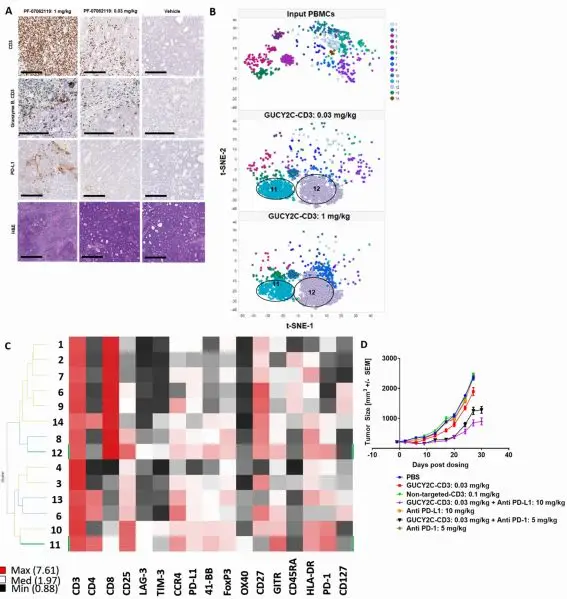
4、联合抗血管生成治疗:
在PDX模型中,PF-07062119与抗VEGF-A联用可进一步增加T细胞浸润,并在更低剂量下实现肿瘤完全消退。
安全性评估:
食蟹猴毒理学研究显示,PF-07062119可逆性副作用包括呕吐、轻微腹泻及体重下降(≤7%),无严重毒性。
首次给药后观察到细胞因子(IFN-γ、IL-2等)释放,但二次给药后减弱,提示耐受性良好。
GUCY2C靶向的其他治疗策略
1、肿瘤疫苗Ad5-GUCY2C-PADRE:
美国Sidney Kimmel癌症中心开发的腺病毒载体疫苗,通过激活CD8+T细胞(不激活CD4+T细胞)预防转移。
I期试验(n=10)显示40%患者产生特异性T细胞应答,无≥2级不良事件,目前进入II期(涵盖CRC、胃癌等)。
2、CAR-T疗法:
靶向hGUCY2C的鼠源CAR-T在临床前模型中可抑制肺转移并延长生存期。
GUCY2C的生物学特性
鸟苷酸环化酶C(GUCY2C)是一种肠上皮特异性跨膜受体,其激活后可催化GTP生成cGMP,调节离子分泌、肠道屏障功能及细胞增殖。在CRC中:
原发性及转移性病灶均高表达GUCY2C(转移灶表达量达正常2~10倍);
配体(鸟苷素/尿苷素)下调导致肠道屏障破坏,促进肿瘤发生。
GUCY2C结构示意图
总结与展望
GUCY2C靶向疗法(双抗、疫苗、CAR-T)展现出以下优势:
广谱性:疗效不受KRAS/BRAF突变影响;
联合潜力:与免疫检查点或抗血管药物协同增效;
安全性:临床前数据支持可控毒性。
目前,Ad5-GUCY2C-PADRE疫苗进展最快(II期),而PF-07062119及CAR-T仍需临床验证。若成功,GUCY2C靶点有望为CRC(尤其是MSS型及难治性突变患者)提供突破性治疗方案。
1、《一种新型GUCY2C-CD3 T细胞衔接双特异性抗体(PF-07062119)用于胃肠道癌症治疗》;《临床癌症研究》2020年1月29日在线首发;
2、《分裂耐受性使结肠癌患者安全产生Ad5-GUCY2CPADRE疫苗诱导的T细胞应答》;《癌症免疫治疗杂志》(2019)7:104;
3、《靶向GUCY2C的癌症免疫治疗:过去、现在与未来》;《免疫学研究》(2011)51:161-169;
4、《靶向人GUCY2C的嵌合抗原受体(CAR)T细胞消除结直肠癌转移灶》;《癌症免疫学研究》2018年4月3日在线首发;
5、《GUCY2C在肥胖与癌症的交叉点》;《内分泌代谢趋势》2013年4月第24卷第4期;
6、《鸟苷酸环化酶C作为胃肠道疾病的治疗靶点》;Waldman SA, Camilleri M.《肠道》2018;67:1543-1552.doi:10.1136/gutjnl-2018-316029













