- 最新进展
- 参考文献
引言
2016年3月,Nature Reviews Clinical Oncology发表题为"PD-1 says goodbye, TIM-3 says hello"的综述,将HAVCR2(编码TIM-3蛋白)推至肿瘤免疫治疗研究前沿。作为TIM家族(TIM1/HAVCR1、TIM3/HAVCR2、TIM4/TIMD4)的重要成员,TIM-3因其在自身免疫及肿瘤免疫调控中的关键作用备受关注。
TIM-3的生物学特性
TIM-3(T cell immunoglobulin and mucin domain-containing protein 3)最初被鉴定为IFN-γ+ CD4+/CD8+ T细胞的标志性受体,后续研究证实其亦表达于调节性T细胞(Treg)、树突状细胞(DCs)、NK细胞及髓系细胞等。其结构特征包括:
N端IgV结构域:介导配体识别
黏蛋白样域:参与信号转导
跨膜区及胞质尾部:传递抑制性信号
配体互作网络与功能调控
TIM-3通过多配体系统实现免疫微环境特异性调控(图1):
1. Galectin-9
作用机制:与TIM-3 IgV域糖基化位点结合,诱导钙内流及T细胞凋亡
病理意义:在肿瘤微环境(TME)中介导T细胞耗竭
2. Phosphatidylserine (PtdSer)
功能特征:
促进TIM-3+ DCs的抗原交叉呈递
通过"eat-me"信号调控凋亡细胞清除
3. HMGB1
研究进展:虽被鉴定为TIM-3配体,但其结合位点及下游通路尚不明确
4. CEACAM1
调控复杂性:
在结直肠癌模型中显示抑癌作用(CEACAM1−/−小鼠肿瘤负荷增加)
黑色素瘤中高表达可抑制T细胞功能
治疗靶向性:抗TIM-3抗体的疗效与干扰TIM-3/CEACAM1结合能力正相关
图1 | TIM-3配体互作模型
(图示TIM-3 IgV域与各配体的空间结合模式及变构效应)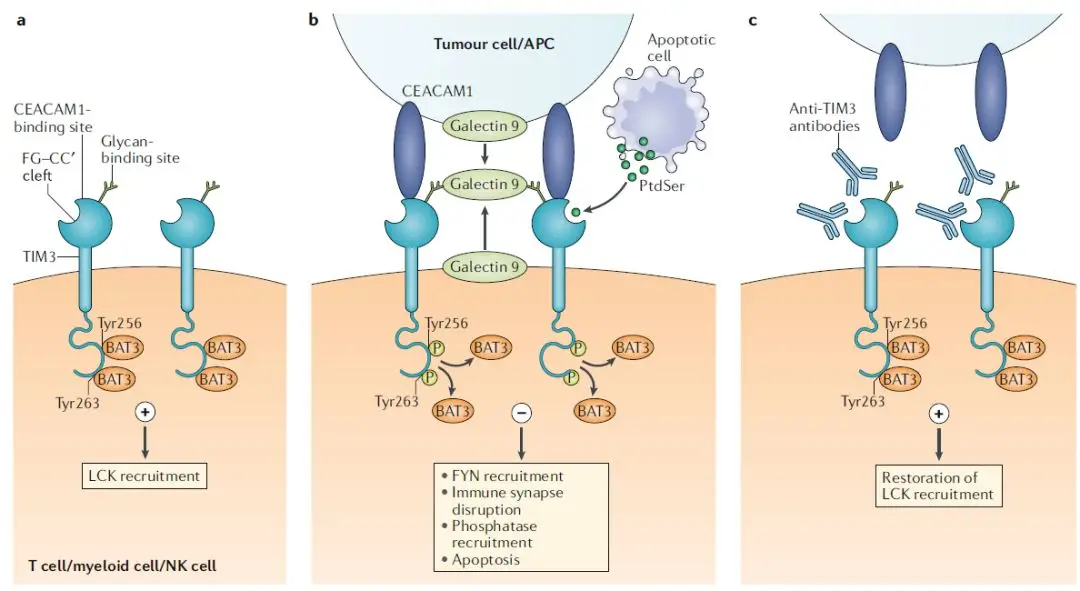
TIM-3在肿瘤免疫逃逸中的核心作用
1. T细胞调控
耗竭标志物:TIM-3+PD-1+ CD8+ T细胞是功能失调最显著的亚群
临床关联:TIM-3高表达与NSCLC、CRC等患者预后不良显著相关(HR=1.8-2.3, p<0.01)
2. 非T细胞功能
| 细胞类型 | TIM-3功能 | 治疗意义 |
|---|---|---|
| Treg | 维持免疫抑制性微环境(肺癌中占Treg的60%) | 靶向清除TIM-3+ Treg |
| DCs | 抑制CXCL9分泌,削弱CD8+ T细胞浸润 | 联合CXCR3激动剂 |
| NK细胞 | 功能障碍标志物 | 阻断可恢复细胞毒性 |
| 髓系细胞 | 促进M2型极化 | 联合CSF-1R抑制剂 |
临床转化研究进展
1. 单药治疗局限性
TSR-022(Tesaro):I期试验中仅1例肉瘤患者达到PR,ORR<5%
机制瓶颈:TIM-3阻断需依赖PD-1通路协同激活
2. 联合治疗策略
PD-1抑制剂:在黑色素瘤/CRC模型中显著提升ORR(小鼠模型:单药20% vs 联合60%)
新型组合:
LY3321367(礼来)+PD-1抗体:I期显示可控毒性(Gr3-4 AE<15%)
双特异性抗体RO7121661:同步靶向TIM-3/PD-1,已进入I期临床
挑战与展望
分子机制深化:需解析TIM-3在不同免疫细胞中的信号转导异质性
生物标志物开发:基于TIM-3表达谱的患者分层策略
下一代药物设计:
变构调节抗体(选择性阻断特定配体)
三特异性抗体(TIM-3/PD-1/LAG-3)
结论:HAVCR2作为免疫治疗的新兴靶点,其多细胞调控特性为克服PD-1耐药提供了新思路。随着对TIM-3配体互作及组织特异性功能的深入理解,针对该通路的精准干预策略有望成为肿瘤免疫治疗的重要突破点。
[1] Monney,L.等人。Th1特异性细胞表面蛋白Tim-3调节巨噬细胞活化和自身免疫性疾病的严重程度。《自然》(2002)
[2] Yochai-Wolf等人。TIM3是一种抑制性受体。《自然评论免疫学》(2019)。
[3] Chiba,S.等人。肿瘤浸润性树突状细胞通过受体TIM-3和危言耸听HMGB1之间的相互作用抑制核酸介导的先天免疫反应。《自然免疫学》(2012)。
[4] Leung,N.等人。在致癌的小鼠模型中,癌胚抗原相关细胞粘附分子1(Ceacam1)基因的缺失有助于结肠肿瘤的进展。癌基因(2006)。
[5] Wiener,Z.等人。TIM-3在黑色素瘤细胞中表达,在TGF-β刺激的肥大细胞中上调。J.投资。皮肤科。(2007).













