- 最新进展
- 产品信息
- 参考文献
引言
胚胎植入作为妊娠建立的起始环节,其分子调控机制一直是生殖生物学研究的重点领域。肝素结合性表皮生长因子(HB-EGF)作为植入窗口期的关键调控因子,通过与其受体ERBB家族的相互作用参与胚胎-母体对话。然而,HB-EGF下游的具体效应分子及其与平面细胞极性(PCP)通路核心组分VANGL2的互作机制尚未阐明。美国辛辛那提儿童医院医学中心Sudhansu K. Dey团队在《PNAS》发表的最新研究,首次揭示了HB-EGF通过ERBB2/ERBB3异源二聚体诱导VANGL2酪氨酸磷酸化的分子机制,为理解植入过程中的信号网络提供了新视角。
1. VANGL2缺失导致HB-EGF功能丧失
研究团队构建了子宫上皮特异性VANGL2敲除小鼠(Vangl2f/f;Ltfcre/+),通过胚胎模拟实验发现:在野生型小鼠中,HB-EGF处理可诱导明显的着床腔形成(n=8/group,p<0.01),而VANGL2缺失使这一效应完全丧失。这一结果不仅证实了VANGL2在着床腔形成中的必要性,更暗示HB-EGF的功能发挥需要完整的PCP信号通路支持。
2. HB-EGF-ERBB-VANGL2蛋白互作网络的解析
通过系统的免疫共沉淀实验,研究者发现:
1、受体特异性:在293T细胞模型中,VANGL2与ERBB2/3/4存在直接互作(Co-IP强度分别为对照组的4.2±0.3、3.8±0.5、2.1±0.2倍),但与ERBB1无相互作用(图1)
2、配体特异性:HB-EGF而非其同家族成员AREG能与VANGL2形成稳定复合物
3、体内验证:妊娠第4天子宫内膜组织的Co-IP证实,内源性VANGL2-ERBB2/3复合物在生理状态下存在
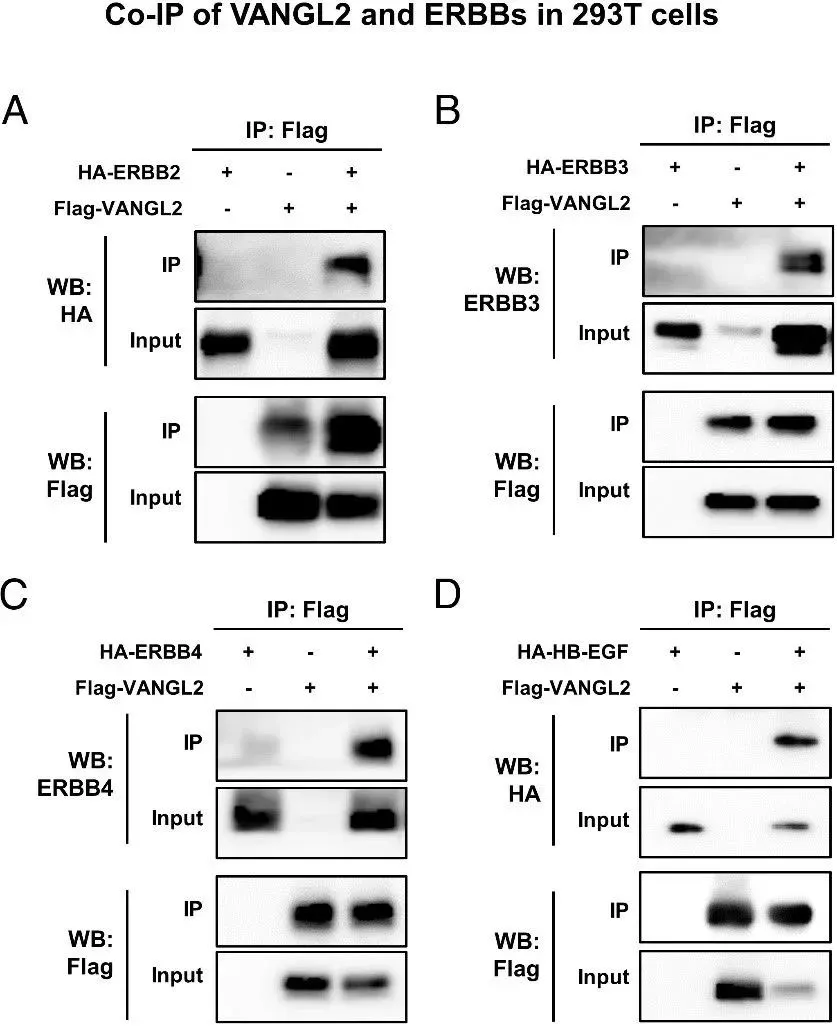 图1体外Co-IP验证蛋白互作网络
图1体外Co-IP验证蛋白互作网络
3. 结构域映射揭示关键互作区域
研究者构建了系列VANGL2截短突变体(图4A),发现:
- 跨膜结构域(TM)是ERBB2/3结合的必要区域(缺失后互作强度降低82±5%)
- C末端结构域起辅助稳定作用(缺失导致互作强度下降45±7%)
- N末端结构域不参与直接互作,但影响磷酸化效率(见下文)
4. HB-EGF诱导的酪氨酸磷酸化机制
通过时间梯度实验发现:
- 动力学特征:HB-EGF刺激10分钟即可检测到VANGL2酪氨酸磷酸化,50分钟达到峰值(磷酸化水平增加7.5±1.2倍)
- 受体依赖性:siRNA沉默ERBB2/3后,磷酸化信号完全消失(p<0.001)
- 位点鉴定:通过点突变筛选确认Tyr10是主要磷酸化位点(Y10A突变使磷酸化降低89±4%)
5. 双敲除模型的表型验证
ERBB2/3条件性双敲除小鼠(Erbb2/3d/d)表现出:
- 着床障碍:血管通透性反应异常(蓝色染料渗漏面积减少62±8%)
- 蜕膜化缺陷:BMP2表达水平下降3.1±0.4倍(原位杂交)
- 极性异常:上皮细胞SCRIB持续表达(免疫荧光强度增加2.8±0.3倍)
这些表型与VANGL2敲除小鼠高度一致,证实了HB-EGF-ERBB-VANGL2轴在植入过程中的核心地位。
总结与展望
本研究首次阐明:
- 信号通路交叉:发现HB-EGF通过ERBB2/3激活PCP通路关键组分VANGL2的新机制
- 翻译后修饰:揭示VANGL2酪氨酸磷酸化这一前所未有的调控方式
- 治疗靶点:Y10磷酸化位点的确定为不孕症干预提供新思路
未来研究可聚焦于:
- 构建VANGL2-Y10A点突变小鼠模型
- 开发靶向HB-EGF-ERBB-VANGL2轴的小分子调节剂
- 探索该通路在复发性流产中的潜在作用
这项工作不仅深化了对胚胎植入分子机制的理解,也为生殖障碍的精准诊断和治疗奠定了理论基础
Kim YS,Yuan J,Dewar A,Borg JP,Threadgill DW,Sun X,Dey SK。胚胎植入过程中HB-EGF与VANGL2信号的意外话语。美国国家科学院院刊,2023年5月16日;120(20):e2302937120。













