白细胞介素(Interleukins)与肿瘤:功能和作用机制
在肿瘤微环境(Tumor Microenvironment, TME)的复杂调控网络中,细胞因子作为关键信号分子介导免疫细胞与非免疫细胞的动态相互作用,深刻影响肿瘤发生发展。
- 最新进展
- 产品信息
最新进展
白细胞介素(Interleukins)与肿瘤:功能和作用机制
在肿瘤微环境(Tumor Microenvironment, TME)的复杂调控网络中,细胞因子作为关键信号分子介导免疫细胞与非免疫细胞的动态相互作用,深刻影响肿瘤发生发展。研究证实,肿瘤微环境通过适应性演化促进恶性细胞与免疫反应的异常对话,这种平衡在肺腺癌等实体瘤进展中起决定性作用。白细胞介素(Interleukins, ILs)家族因在免疫调节中的核心地位成为研究焦点,其通过多样化细胞来源、特异性受体识别及复杂信号网络,在肿瘤微环境中展现显著多效性,涵盖肿瘤发生、进展及免疫控制等阶段,且呈剂量依赖性。本文系统梳理白细胞介素家族在肿瘤微环境的表达模式、信号机制及双重作用,为理解肿瘤免疫调控和开发靶向策略提供参考。
一、白细胞介素家族的分类及肿瘤微环境中的表达特征
白细胞介素家族由结构相关但功能各异的细胞因子组成,依分子结构、受体类型及功能分为多个亚家族。其在肿瘤微环境的细胞来源广泛,包括浸润免疫细胞(T 细胞、巨噬细胞、自然杀伤细胞)、肿瘤细胞及基质细胞(成纤维细胞、内皮细胞),表达水平与肿瘤类型、分期及预后密切相关。
IL-1 家族作为先天性免疫关键调节因子,在肿瘤微环境中常异常高表达。IL-1α 和 IL-1β 主要由活化巨噬细胞、树突状细胞及肿瘤相关成纤维细胞分泌,通过 IL-1R1/IL-1R3 复合物传递信号;IL-33 由基质细胞和内皮细胞释放,发挥免疫调节作用。IL-18 家族中 IL-18 来自活化巨噬细胞和树突状细胞,IL-37 常见于调节性 T 细胞(Treg)和髓系抑制细胞。
IL-2 家族在适应性免疫中起核心作用,表达具严格细胞活化依赖性。IL-2 由活化 CD4⁺T 细胞分泌,IL-4 来源于 Th2 型辅助 T 细胞,IL-7 由基质成纤维细胞持续产生,为 T 细胞存活提供关键信号。IL-6 家族作为炎症介质,IL-6 由肿瘤相关巨噬细胞和基质细胞分泌,在炎症相关性肿瘤中高表达;IL-11 在多种上皮源性肿瘤中高表达,与转移密切相关。
IL-12 家族功能分化鲜明,IL-12 由树突状细胞和巨噬细胞在病原体刺激下产生,IL-23 在髓系细胞中持续表达,通过调节 Th17 细胞影响肿瘤进展。IL-17 家族的 IL-17A/F 由 Th17 细胞、γδT 细胞分泌,与实体瘤不良预后相关;IL-25(IL-17E)由上皮细胞和肥大细胞产生,参与 Th2 型极化。
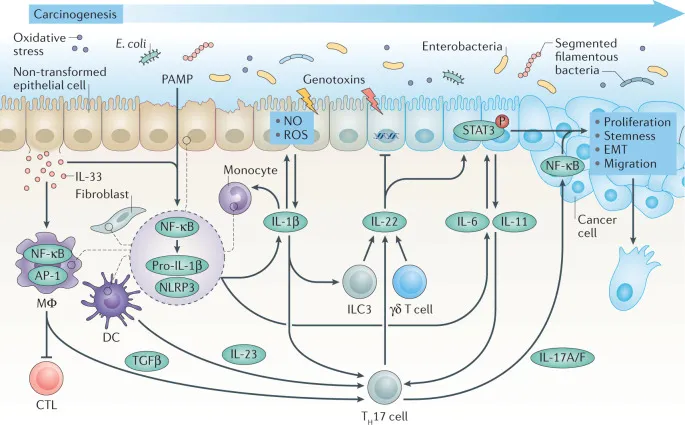
二、白细胞介素在肿瘤发生中的双重作用机制
白细胞介素在肿瘤发生中呈显著双重性,部分通过促炎、抑制抗肿瘤免疫发挥促肿瘤作用,另一些则激活效应免疫细胞、抑制肿瘤增殖发挥抗肿瘤功能,功能差异取决于作用细胞类型及微环境。
(一)促肿瘤作用的分子机制
多种白细胞介素通过诱导慢性炎症微环境、促进肿瘤增殖及血管生成参与肿瘤发生。IL-6 通过经典(IL-6Rα/gp130)和反式(可溶性 IL-6Rα/gp130)信号通路激活 JAK/STAT3、MAPK 等,促进肿瘤无限增殖和抗凋亡,诱导 VEGF 表达加速新生血管形成,在结直肠癌、肝癌中通过维持慢性炎症促进上皮细胞恶性转化。
IL-17 家族多机制促肿瘤进展,IL-17A 激活 NF-κB 诱导 MMPs 表达增强侵袭转移,招募中性粒细胞和巨噬细胞形成免疫抑制微环境。IL-23 激活 Th17 细胞促进 IL-17 分泌,形成 “IL-23/IL-17” 炎症轴,在乳腺癌、黑色素瘤中加速血管和淋巴管生成,促进远处转移。
IL-33 激活肥大细胞、嗜碱性粒细胞分泌 Th2 型细胞因子,促进 M2 型巨噬细胞极化形成免疫抑制微环境,还直接增强肿瘤细胞存活和化疗耐药。IL-10 家族的 IL-20 和 IL-22 激活肿瘤细胞受体复合物,促进 EMT 增强迁移能力,在胃癌、结直肠癌中与淋巴结转移相关。
(二)抗肿瘤作用的调控网络
部分白细胞介素通过激活适应性免疫、增强效应细胞功能发挥抗肿瘤作用。IL-12 激活 STAT4 诱导 naive T 细胞向 Th1 分化,促进 IFN-γ 分泌增强 CTL 杀伤能力,激活 NK 细胞增强肿瘤识别裂解,在多种模型中显免疫增强效应。
IL-2 与 T 细胞表面受体结合提供增殖信号,促进效应 T 细胞克隆扩增,增强 NK 细胞毒性,在肿瘤免疫监视中起重要作用。IL-18 协同 IL-12 诱导 T 细胞和 NK 细胞产生大量 IFN-γ,增强抗肿瘤应答,促进记忆 T 细胞形成维持长期免疫记忆。
IL-7 通过激活 PI3K/Akt 抑制 T 细胞凋亡,维持效应 T 细胞存活和功能,在免疫检查点抑制剂治疗中增强 T 细胞抗原应答,逆转耗竭。IL-27 诱导 NK 细胞和 CTL 细胞毒性分化,在肿瘤早期免疫监视中作用关键,分泌水平与多种肿瘤预后正相关。
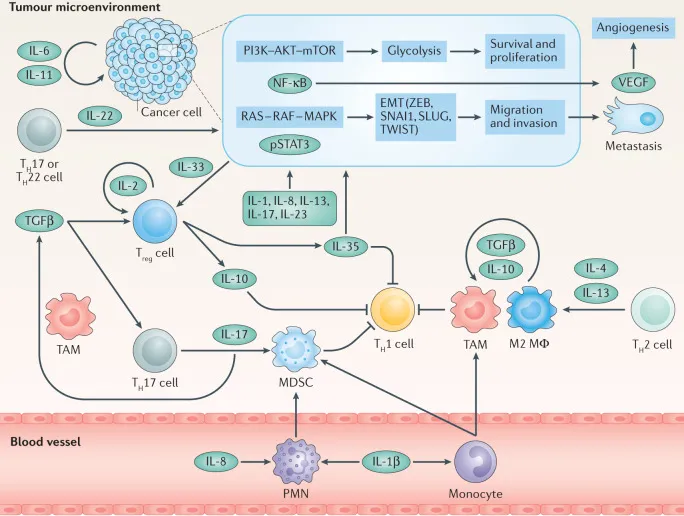
三、典型白细胞介素家族成员的肿瘤调控作用
不同白细胞介素家族成员在肿瘤微环境中具独特功能特征,解析其机制为理解免疫调控网络提供视角。
IL-1 家族呈复杂双重作用,IL-1α 和 IL-1β 激活 NF-κB 促炎症致癌,同时招募树突状细胞和 CTL 启动抗肿瘤免疫。IL-1β 高表达与多种肿瘤不良预后相关,靶向单抗在临床试验中显抑瘤潜力。IL-33 主要促肿瘤,通过促进 Treg 功能和 Th2 极化抑制免疫应答,表达水平与乳腺癌、肺癌分期正相关。
IL-12 家族功能分化显著,IL-12 诱导 IFN-γ 激活适应性免疫,是肿瘤免疫治疗重要增强剂;IL-23 通过促进 Th17 分化和 IL-17 分泌促肿瘤,与血管生成、转移密切相关。IL-35 由 Treg 分泌,抑制效应 T 细胞增殖和毒性功能促免疫逃逸,高表达预示不良预后。
IL-6 家族的 IL-6 和 IL-11 是重要促癌因子,IL-6 激活 STAT3 维持肿瘤干细胞特性促复发耐药;IL-11 激活 gp130/STAT3 增强间质转化和转移能力,在胰腺癌、乳腺癌中高表达。IL-10 家族的 IL-10 抑制树突状细胞成熟形成免疫抑制微环境,IL-24 诱导肿瘤细胞凋亡和自噬,其缺失常见于多种恶性肿瘤。
IL-2 家族的 IL-2 促 T 细胞和 NK 细胞生长抗肿瘤,同时维持 Treg 功能和诱导 AICD 终止过度应答,需精确调控剂量。IL-7 维持 T 细胞库多样性和功能完整,表达水平与免疫检查点抑制剂治疗响应正相关。

四、白细胞介素在肿瘤治疗中的潜在应用价值
白细胞介素家族因在肿瘤免疫调控中的核心地位成为重要治疗靶点,基于其功能的策略在临床研究中获进展。
针对促肿瘤白细胞介素的中和策略获验证,靶向 IL-6 受体单抗在多发性骨髓瘤中显效,抑制增殖和骨损伤;抗 IL-17A 抗体在动物模型中抑血管生成和转移,实体瘤临床试验正在开展。IL-1R 拮抗剂阻断 IL-1 家族信号,在炎症相关性肿瘤中降进展风险,结直肠癌、肺癌中前景广阔。
基于抗肿瘤白细胞介素的免疫增强疗法成重要方向,重组 IL-12 增强 Th1 应答,在黑色素瘤、肾癌中显一定疗效;IL-2 作为首个获批细胞因子疗法,在肾细胞癌和黑色素瘤中诱导持久应答,但受系统性毒性限制。IL-7 和 IL-15 等被探索增强免疫检查点抑制剂疗效,临床前研究显逆转 T 细胞耗竭,增强浸润 T 细胞功能。
联合治疗成提升疗效关键,IL-12 与 PD-1/PD-L1 抑制剂联合显协同效应;IL-2 与 CAR-T 结合增强其存活增殖,提高响应率。基于白细胞介素表达谱的肿瘤分型为个体化免疫治疗提供依据,有望提升精准性和有效性。
尽管白细胞介素靶向治疗面临细胞因子多效性致脱靶、个体响应差异等挑战,但随机制研究深入和给药优化,有望成为肿瘤免疫治疗重要突破口,为攻克恶性肿瘤提供新选择。
产品信息













