- 最新进展
- 产品信息
最新进展
神经调节蛋白 1(NRG1)融合作为一种罕见的致癌驱动机制,近年来在非小细胞肺癌(NSCLC)研究中受到广泛关注。NRG1 融合通过异常激活表皮生长因子受体(EGFR)家族信号通路,推动肿瘤发生发展,为肺癌精准治疗提供了全新方向。本文系统阐述 NRG1 融合在 NSCLC 中的分子特征、患者临床表型、检测方法、信号调控机制及现有治疗策略,全面解析这一新兴治疗靶点的研究现状与临床价值。
一、NRG1 融合的分子特征与肺癌分布
NRG1 作为表皮生长因子家族的重要成员,位于 8 号染色体短臂,其编码的神经调节蛋白 1 通过与 HER3(ERBB3)和 HER4(ERBB4)受体结合,在正常组织发育、细胞增殖分化中发挥关键调控作用。当 NRG1 基因与其他基因发生融合时,会形成具有致癌活性的融合蛋白,这种基因组异常被称为 NRG1 融合,是继 EGFR 突变、ALK 融合之后发现的又一重要致癌驱动事件。
在实体瘤中,NRG1 融合最常见于非小细胞肺癌,尤其在肺腺癌亚型中占据主导地位。目前已发现 20 多种 NRG1 融合伴侣基因,其中 CD74-NRG1 融合是临床最常见的亚型,约占所有 NRG1 融合 NSCLC 的 50% 以上。其他较为常见的融合伴侣包括 SLC3A2、TPM3、MBD1 等,不同融合伴侣可能通过影响融合蛋白的表达水平、亚细胞定位及信号激活强度,导致肿瘤生物学行为的差异。这些融合事件通过基因组易位、倒置等机制产生,使 NRG1 的表皮生长因子样结构域持续暴露,从而异常激活下游信号通路,驱动肿瘤发生。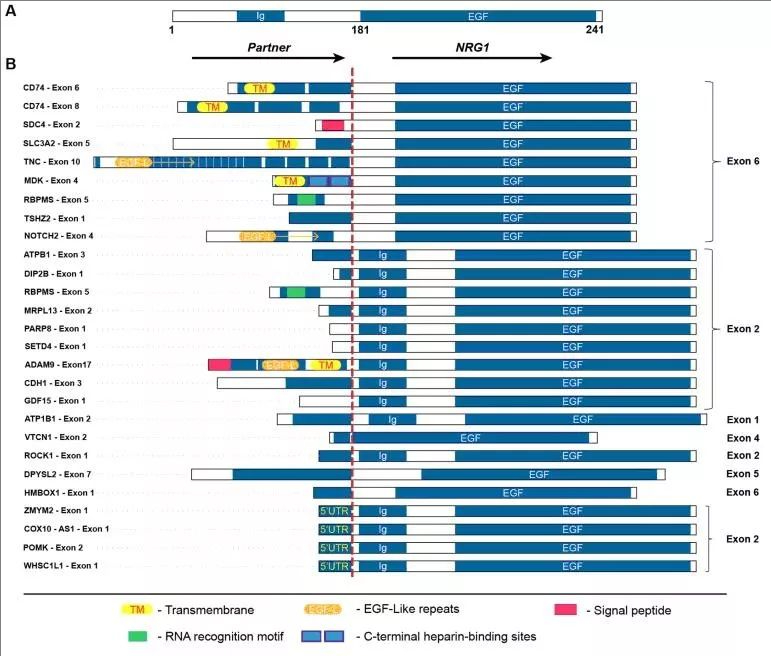

二、NRG1 融合 NSCLC 的患者临床特征
NRG1 融合在非小细胞肺癌中总体发生率较低,约占所有 NSCLC 病例的 0.3%,但在特定亚型中发生率显著升高。在肺腺癌患者中,NRG1 融合发生率约为 1.7%,而在浸润性黏液肺腺癌(IMA)这一特殊亚型中,发生率可高达 7%-10%,成为该亚型重要的分子特征。多中心临床研究数据显示,在 117 例 NRG1 融合 NSCLC 患者中,95% 为腺癌病理类型,其中 75% 确诊为浸润性黏液肺腺癌,提示 NRG1 融合与黏液腺癌的病理分化存在密切关联。
从临床表型来看,NRG1 融合 NSCLC 患者具有独特的人口学特征:中位发病年龄为 66 岁,略高于其他驱动基因阳性肺癌患者;女性患者比例较高,约占 55%;不吸烟或轻度吸烟患者占比达 44%,显著高于吸烟相关肺癌人群。在疾病分期分布上,NRG1 融合患者确诊时涵盖各临床阶段,其中 I 期占 32.5%,II 期占 18.8%,III 期占 9.4%,IV 期占 10.5%,表明该分子异常可在疾病早期出现并持续驱动肿瘤进展。值得注意的是,晚期患者预后相对较好,29 例 IV 期患者的中位生存期达 4.83 年,其中 12 例接受阿法替尼治疗的患者显示出一定生存获益,为临床治疗提供了参考依据。
三、NRG1 融合的检测方法与共存基因特征
精准检测 NRG1 融合是实现靶向治疗的前提,目前临床常用的检测方法包括荧光原位杂交(FISH)、RNA 测序(RNA-seq)和 DNA 测序技术,每种方法各具优势与局限性。FISH 技术通过特异性探针识别 NRG1 基因重排,具有较高灵敏度,但无法确定具体融合伴侣;RNA 测序能够直接检测融合转录本,明确融合伴侣类型和断点位置,为治疗方案选择提供更详细信息,是目前推荐的首选检测方法;DNA 测序可发现基因组水平的融合断点,但对低丰度融合的检出能力相对较弱,常作为补充检测手段。
NRG1 融合在肺癌基因组中呈现独特的共突变模式,其与已知的其他致癌驱动基因几乎不共存。临床研究显示,NRG1 融合 NSCLC 患者中极少同时存在 EGFR 突变、ALK 融合、ROS1 融合或 RET 融合等常见驱动事件,这种排他性特征支持 NRG1 融合作为独立致癌驱动因子的地位。在共存基因突变中,TP53 突变最为常见,发生率约为 40%-50%,其次是 KRAS 突变(约 10%)和 CDKN2A 缺失(约 8%)。这些共存突变可能通过影响 DNA 损伤修复、细胞周期调控等通路,参与肿瘤耐药和恶性进展,为理解 NRG1 融合肺癌的生物学行为提供了基因组学依据。
四、NRG1 融合的信号激活机制
NRG1 融合致癌的核心机制在于异常激活 HER 家族信号通路。正常生理状态下,NRG1 需通过蛋白酶解加工释放可溶性 EGF 样结构域,才能与 HER3/HER4 受体结合;而 NRG1 融合蛋白因伴侣基因的结构特性,无需加工即可持续暴露 EGF 样结构域,实现受体的配体非依赖性激活。研究表明,NRG1 融合蛋白主要通过与 HER3 结合,诱导 HER3 与 HER2 形成异源二聚体,激活受体酪氨酸激酶活性,进而启动下游信号级联反应。
在信号传导层面,激活的 HER2/HER3 复合体通过磷酸化募集 PI3K/AKT/mTOR 和 RAS/RAF/MEK/ERK 等关键信号通路,调控细胞增殖、存活、迁移等生物学过程。PI3K/AKT 通路的持续激活可抑制细胞凋亡,促进肿瘤细胞存活;RAS/RAF 通路异常则加速细胞周期进程,导致细胞无限增殖;同时,这些通路还可通过调控上皮间质转化(EMT)相关基因表达,增强肿瘤侵袭转移能力。这种多通路协同激活的特性,使得 NRG1 融合肺癌呈现出较强的恶性表型,也为靶向治疗提供了多个潜在干预节点。

五、NRG1 融合 NSCLC 的治疗策略
目前 NRG1 融合 NSCLC 的治疗仍处于探索阶段,现有治疗方案主要基于 HER 家族靶向药物和传统化疗。在靶向治疗方面,阿法替尼作为一种不可逆的泛 HER 抑制剂,能够同时抑制 EGFR、HER2 和 HER4 的酪氨酸激酶活性,是目前临床应用最多的 NRG1 融合抑制剂。临床数据显示,阿法替尼治疗 NRG1 融合晚期 NSCLC 可实现一定程度的肿瘤控制,部分患者获得客观缓解,但总体响应率仍有待提高,中位无进展生存期约为 5-6 个月。除阿法替尼外,HER3 单克隆抗体(如 Patritumab)通过阻断 NRG1 与 HER3 的结合,在早期临床试验中显示出一定治疗潜力,尤其在 CD74-NRG1 融合患者中观察到部分缓解案例。
免疫检查点抑制剂在 NRG1 融合 NSCLC 中的治疗效果不佳。临床研究显示,无论是 PD-1/PD-L1 单药治疗还是化疗联合免疫治疗,对 NRG1 融合晚期患者的客观缓解率均为 0,提示该亚型肺癌可能具有免疫沙漠或免疫排斥表型,免疫治疗获益有限。在这种情况下,化疗仍是晚期患者的主要治疗选择,其中培美曲塞联合铂类方案表现出相对较好的疗效,可作为一线治疗推荐。对于靶向治疗进展后的患者,多西他赛、紫杉醇等二线化疗药物也可用于疾病控制,但总体预后仍不理想。
随着对 NRG1 融合机制研究的深入,双特异性抗体、ADC 药物(抗体药物偶联物)等新型治疗策略正在临床前或早期临床研究中评估,有望为 NRG1 融合 NSCLC 患者带来新的治疗希望。
产品信息













