- 最新进展
- 产品信息
- 参考文献
最新进展
Noggin 作为转化生长因子 β(TGF-β)超家族的重要调控因子,通过特异性拮抗骨形态发生蛋白(BMP)信号通路在胚胎发育、组织稳态及干细胞命运决定中发挥关键作用。在类器官培养技术快速发展的背景下,Noggin 作为核心添加因子,其活性稳定性直接影响干细胞增殖与分化的精准调控。本文系统阐述 Noggin 蛋白的分子功能、BMP 信号通路的调控机制,重点介绍基于报告基因技术的 Noggin 活性检测方法及其在类器官培养质控中的应用价值。
一、BMP 信号通路的生物学功能与调控机制
骨形态发生蛋白(BMP)家族作为 TGF-β 超家族的重要分支,参与调控从胚胎发育到成体组织稳态的多个生物学过程。在骨骼系统中,BMP 通过促进成骨细胞增殖与分化维持骨形成平衡;在胚胎发育阶段,BMP 信号调控体轴建立、肢体发育及器官发生;在成体组织中,BMP 通路参与干细胞自我更新、组织修复及免疫调节等生理过程。此外,BMP 信号异常与多种疾病密切相关,包括骨代谢疾病、纤维化疾病及肿瘤发生发展,其通路活性的精准调控对维持细胞稳态至关重要。
BMP 信号通路的激活遵循经典的 Smad 依赖机制。当 BMP 配体与细胞膜表面的 I 型受体(Alk1、Alk2、Alk3、Alk6)和 II 型受体(BMPR2、ActRIIa、ActRIIb)结合后,形成异源三聚体受体复合物,II 型受体通过磷酸化激活 I 型受体的丝氨酸 / 苏氨酸激酶活性。激活的 I 型受体进一步磷酸化下游的受体激活型 Smad(R-Smads,包括 Smad1、Smad5 和 Smad8),磷酸化的 R-Smads 与共同介导型 Smad(co-Smad,Smad4)形成异源复合体,随后转位进入细胞核,结合到靶基因启动子区域的 Smad 结合元件上,启动 Id1、SnoN、SMAD6 等下游基因的转录,从而实现对细胞增殖、分化及凋亡的调控。除经典 Smad 通路外,BMP 还可通过激活 MAPK 等非 Smad 通路发挥生物学功能,构成复杂的信号调控网络。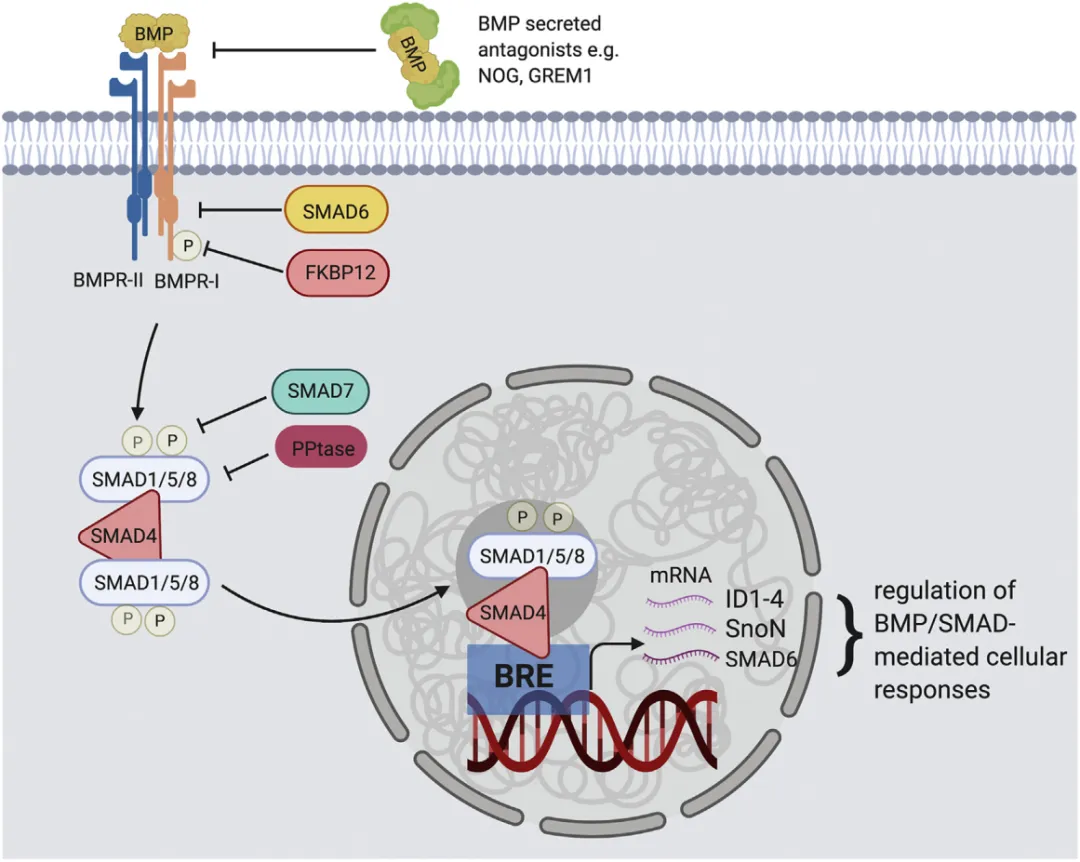

BMP信号通路
二、Noggin 蛋白的分子功能与类器官培养中的作用
Noggin 是一种分泌型糖蛋白,作为 BMP 信号通路的特异性拮抗剂,在细胞外空间发挥关键调控作用。其分子机制是通过与 BMP 配体(如 BMP2、BMP4、BMP7)高亲和力结合,形成稳定的 Noggin-BMP 复合体,从而阻断 BMP 与细胞膜表面受体的相互作用,抑制受体激活及下游信号传导。这种拮抗作用具有高度特异性,Noggin 对 TGF-β、Activin 等其他 TGF-β 超家族成员无明显抑制效应,保证了信号调控的精准性。
在类器官培养体系中,Noggin 是维持干细胞特性和促进类器官长期稳定生长的核心因子。类器官作为体外三维培养形成的微型器官模型,其发育依赖于干细胞微环境中多种信号通路的协同调控,其中 Wnt 信号与 BMP 信号的平衡至关重要。Noggin 通过抑制内源性 BMP 信号,解除其对 Wnt 通路的抑制作用,从而维持干细胞的自我更新能力和增殖活性。在肝脏类器官培养中,Noggin 可促进肝干细胞的扩增并维持其分化潜能;在小肠类器官培养中,Noggin 与 Wnt3a、R-spondin 协同作用,支持隐窝 - 绒毛结构的形成和功能维持;在输卵管类器官培养中,Noggin 通过调控上皮细胞增殖与分化,维持类器官的形态完整性。因此,Noggin 蛋白的活性稳定性是类器官培养成功的关键因素之一,建立可靠的活性检测方法对类器官研究具有重要意义。
三、BMP 报告基因检测的原理与应用
BMP 报告基因检测(BRE-Luc Reporter Gene Assay)是基于转录调控原理建立的高灵敏度通路活性检测方法,为 BMP 信号通路研究和药物筛选提供了有力工具。其核心原理是利用 BMP 下游靶基因 Id1 启动子中的 Smad 结合元件(BMP-responsive element, BRE),将该元件序列插入荧光素酶报告基因的上游启动子区域,构建 BRE-Luc 报告基因质粒。当 BMP 信号通路被激活时,R-Smad-Smad4 复合体结合到 BRE 序列上,驱动荧光素酶基因的表达,通过检测荧光素酶活性即可定量反映 BMP 通路的激活水平。
该检测方法通过构建稳定转染 BRE-Luc 报告基因的细胞系实现对 BMP 通路活性的高效监测。在实验体系中,外源性添加 BMP 配体(如 BMP2)可显著诱导报告基因表达,使细胞内萤火虫荧光素酶活性升高,且该反应具有 BMP 特异性,对 TGF-β 等其他信号分子无交叉反应,保证了检测的特异性和准确性。基于这一特性,BRE-Luc 报告基因检测广泛应用于 BMP 通路激动剂和拮抗剂的筛选与评价,在药物研发中发挥重要作用。例如,通过检测候选化合物对 BMP 诱导的荧光素酶活性的影响,可快速筛选出具有潜在开发价值的 BMP 通路调节剂。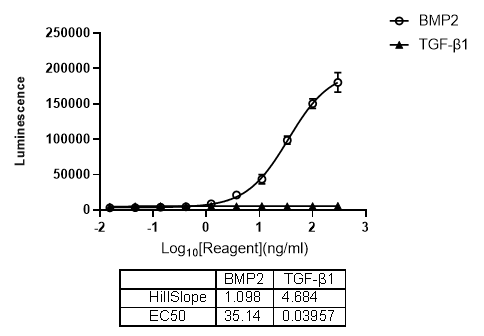

BMP2特异性激活BRE报告基因
四、Noggin 蛋白活性检测的实验方法与质控应用
基于 BRE-Luc 报告基因检测系统,可建立高效、特异的 Noggin 蛋白活性检测方法,用于类器官培养中 Noggin 蛋白的质量控制。其检测原理是利用 Noggin 对 BMP 信号通路的拮抗作用:在 BRE-Luc 报告基因细胞系中,预先加入 BMP 配体可诱导荧光素酶高表达;当同时加入具有活性的 Noggin 蛋白时,Noggin 与 BMP 结合阻断其信号传导,导致荧光素酶活性随 Noggin 浓度增加而降低,通过检测荧光素酶活性的抑制程度可定量评价 Noggin 的生物学活性。
具体实验流程包括:将稳定表达 BRE-Luc 报告基因的细胞接种于 96 孔板,培养至对数生长期;设置空白对照组、BMP 阳性对照组、Noggin 梯度浓度实验组,分别加入相应试剂并孵育一定时间;孵育结束后,加入荧光素酶底物,使用化学发光检测仪测定各孔的荧光素酶活性;以 BMP 阳性对照组的荧光素酶活性为参照,计算不同浓度 Noggin 对 BMP 诱导的报告基因活性的抑制率,绘制剂量效应曲线,通过半数抑制浓度(IC50)等参数评价 Noggin 活性。该方法具有灵敏度高、特异性强、可量化等优点,能够有效区分活性 Noggin 与失活蛋白,确保类器官培养中添加的 Noggin 质量稳定可靠。
在类器官培养实践中,Noggin 活性检测作为关键质控环节,可有效监控蛋白批次差异、储存条件对活性的影响,保证实验结果的可重复性。例如,通过定期检测不同批次 Noggin 对 BMP 通路的抑制活性,可筛选出活性稳定的批次用于类器官培养;对长期储存的 Noggin 进行活性复测,可避免因蛋白失活导致的实验失败,为类器官研究的标准化和规范化提供重要保障。
五、总结与展望
Noggin 作为 BMP 信号通路的关键拮抗剂,在类器官培养和干细胞命运调控中发挥不可替代的作用,其活性稳定性直接影响实验结果的可靠性。基于 BRE-Luc 报告基因检测的 Noggin 活性评价方法,利用 Noggin 对 BMP 通路的特异性拮抗作用,实现了对 Noggin 生物学活性的精准定量,为类器官培养的质量控制提供了标准化手段。该方法不仅适用于 Noggin 蛋白的活性检测,还可拓展应用于其他 BMP 拮抗剂的筛选与评价,在基础研究和药物研发中具有广阔应用前景。随着类器官技术的不断发展,建立完善的关键因子质控体系将进一步推动类器官模型在疾病研究、药物筛选和个性化医疗中的应用。
声明:本篇文章在创作中部分采用了人工智能辅助。如有任何内容涉及版权或知识产权问题,敬请告知,我们承诺将在第一时间核实并撤下。
买重组蛋白,找南京优爱
优爱蛋白专注于提供药物研发、细胞治疗、基因治疗、基础科研所需各种蛋白类试剂原材料和服务,包括药物靶点蛋白、免疫检查点蛋白、细胞因子、工具酶、 蛋白定制表达、全长跨膜蛋白开发等。优爱致力于为客户提供优质的产品和专业服务,打造具有国际竞争力的高新技术企业。
靶点蛋白 | 膜蛋白 | 细胞因子 | 酶 | 病毒抗原 | 蛋白定制
南京优爱生物科技研发有限公司 邮箱:order@ua-bio.com 热线:0571-87565022

产品信息
参考文献
1.Rasheed,N.等人,Atm缺陷小鼠:一种具有成骨细胞分化缺陷和破骨细胞生成增加的骨质疏松症模型。《人类分子遗传学》,2006年。15(12):第1938-48页。
2.Kuilman,T.等人,由白细胞介素依赖性炎症网络介导的癌基因诱导的衰老。细胞,2008。133(6):第1019-31页。
3.王,R.N.,等,骨形态发生蛋白(BMP)信号在发育和人类疾病中的作用。基因疾病,2014。1(1):第87-105页。
©2021-2026 南京优爱生物科技研发有限公司版权所有
网站备案号 浙ICP备2022019033号-2 浙公网安备33010202004867号
电话:0571-87565022
邮箱:order@starter-bio.com
本网站销售的所有产品均不得用于人类或动物之临床诊断或治疗,仅可用于工业或者科研等非医疗目的。












