- 最新进展
- 产品信息
最新进展
在复杂的生命活动中,细胞需持续应对各类环境应激以维持稳态。热休克、重金属暴露等应激条件会触发细胞内一系列适应性反应,其中转录与翻译的动态调控是保障细胞存活的关键环节。近年来,生物分子通过液 - 液相分离(LLPS)形成凝聚物的现象成为细胞应激响应研究的前沿领域。本文围绕负延伸因子(NELF)复合体,系统阐述应激条件下 NELF 核凝聚的形成机制及其在转录下调中的作用,揭示其作为细胞应激生存策略的分子基础。
一、应激响应中的转录调控背景
环境应激可迅速重塑细胞的基因表达模式。在热休克、砷暴露等典型应激条件下,细胞会优先抑制管家基因、代谢相关基因及细胞周期基因的转录与翻译,将资源集中于应激保护相关通路。这种转录重编程的核心机制涉及 RNA 聚合酶 II(Pol II)的活性调控,而 NELF 复合体作为 Pol II 延伸的关键抑制因子,在其中扮演核心角色。
NELF 通过与 Pol II 及基因启动子近端区域结合,可有效阻滞 Pol II 从启动子区向编码区的延伸过程,从而抑制基因转录。传统研究认为应激条件下 NELF 通过增强与染色质的结合实现转录抑制,而最新研究发现,NELF 在应激条件下形成的核凝聚物是其发挥转录调控功能的重要结构基础,为理解细胞应激响应的分子机制提供了全新视角。
二、应激诱导的 NELF 核凝聚特性
应激条件下 NELF 的核凝聚是一个快速且动态的过程。热休克处理可导致整体转录活性显著下调,这一现象可通过 RNA Pol II 的染色质免疫沉淀(ChIP)信号降低得到验证。与此同时,在转录受抑基因的启动子区域,NELF 的结合信号显著增强,且染色质相关 NELF 复合体的丰度明显提高,表明 NELF 向染色质的招募与转录下调存在密切关联。
荧光显微成像显示,荧光标记的 NELFA 亚基在热休克处理 30 分钟内即可重组为明亮的核内斑点结构。这些核斑点具有典型的液体样特性:经荧光漂白恢复(FRAP)实验检测,漂白区域的荧光强度可快速恢复,证明 NELF 分子在凝聚物内部具有高度流动性;时间序列成像观察到小核斑点可融合形成更大的球形结构,体现液体相的融合能力。此外,NELF 核斑点对 1,6 - 己二醇处理高度敏感,而 1,6 - 己二醇可特异性破坏液 - 液相分离形成的凝聚物结构,进一步证实 NELF 核凝聚是通过液 - 液相分离机制实现的。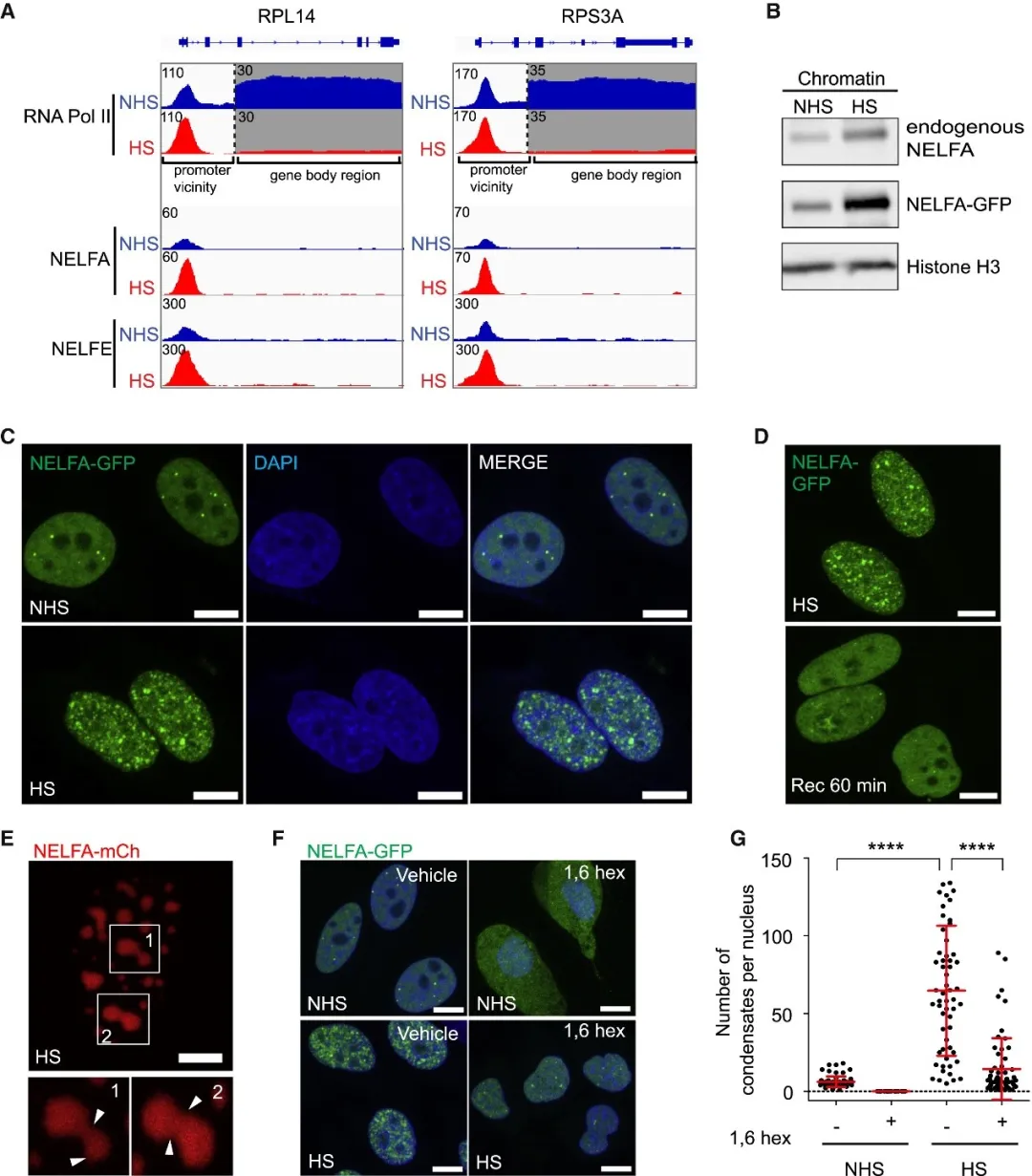

三、NELF 体外相分离的实验验证
体外实验为 NELF 的液 - 液相分离能力提供了直接证据。重组 NELF 复合体在体外特定条件下可自发形成液滴状结构,且这些液滴的形成对离子强度高度敏感:随着氯化钠浓度升高,液滴形成能力显著下降,表明静电相互作用在 NELF 的相分离过程中发挥关键作用。在 50 mM 氯化钠浓度下,NELF 形成液滴的临界浓度约为 0.5 μM,这一浓度范围与生理条件下细胞内 NELF 的表达水平相匹配,提示体外相分离现象具有生理相关性。
体外形成的 NELF 液滴同样展现出液体相的核心特征:液滴间可发生融合,FRAP 实验显示液滴内分子具有快速的动态交换能力。这些结果证实 NELF 复合体自身具备独立的相分离能力,为理解体内 NELF 核凝聚的分子起源提供了重要实验依据。
四、NELF 相分离的翻译后修饰调控机制
应激条件下 NELF 核凝聚的时空特异性调控依赖于精密的翻译后修饰网络,其中去磷酸化和 SUMO 化修饰发挥核心作用。热休克处理可导致 NELFA 蛋白特定氨基酸残基的磷酸化水平持续下降,已知这些残基在正常生理条件下由 P-TEFb 激酶的 CDK9 亚基催化磷酸化。体外实验显示,野生型 P-TEFb 处理可导致 NELF 液滴显著收缩,而催化活性缺失的 P-TEFb 变体则无此效应,表明磷酸化可抑制 NELF 的相分离能力。进一步研究发现,热休克可促进 CDK9 与 LARP7、HEXIM1 等蛋白的相互作用,导致 CDK9 被隔离,从而减少对 NELF 的磷酸化,促进其去磷酸化与核凝聚。
仅 NELF 去磷酸化不足以驱动核凝聚,应激诱导的 SUMO 化修饰是另一关键调控因素。热休克处理可导致 NELF 复合体多个残基的 SUMO 化修饰水平改变,使用 SUMO 激活酶抑制剂 ML-792 处理细胞或通过 siRNA 下调 SUMO 结合 E2 酶 UBC9,均可显著减少 NELF 凝聚物的数量。此外,ZNF451 蛋白的消耗也会降低 NELF 凝聚水平,表明 SUMO 化修饰系统通过多种蛋白协同调控 NELF 的核凝聚过程。

五、NELF 无序区在相分离中的核心作用
NELFA 和 NELFE 亚基含有的天然无序区(IDR),即 “触须” 结构,是驱动 NELF 相分离的关键分子基础。体外实验显示,单独的 GFP-NELFA 触须或 GFP-NELFE 触须融合蛋白均无法形成液滴,而两者以等摩尔比例混合时可高效形成液滴;GFP 与 NELFE 触须的融合蛋白即使在低浓度下也能产生相分离,且形成的液滴对 1,6 - 己二醇敏感。缺失 NELFA 和 NELFE 触须的 NELF 复合体突变体形成液滴的能力显著降低,证实这些无序区是 NELF 相分离的必要且充分条件。
NELF 的无序区还介导了与 Pol II 的相互作用。Pol II 的 C 端无序结构域(CTD)在 NELF 液滴中高度富集,其中远端非重复序列的富集程度更高,且 S5 磷酸化的 CTD 肽段在 NELF 液滴中富集最为显著,表明 NELF 凝聚物可通过无序区与特定修饰状态的 Pol II CTD 形成异型相互作用,这为 NELF 抑制 Pol II 延伸提供了结构基础。
六、NELF 核凝聚的生物学功能解析
NELFA 的 IDR 是驱动细胞内 NELF 核凝聚、转录下调及应激生存的关键元件。缺失 IDR 的 NELFA 突变体(NELFA-ΔIDR)虽可正常定位于细胞核,但在热休克条件下无法形成核凝聚物,且在转录受抑基因的启动子区域结合能力显著下降,导致生长和生物合成相关基因无法正常下调。将 NELFA-ΔIDR 与 FUS 或 EWSR1 的 IDR 融合后,即使在非应激条件下也能形成凝聚物,且可显著降低转录活性,同时提高细胞在热休克条件下的存活率。这些结果证实 NELF 核凝聚通过增强其向启动子的招募,有效驱动转录下调,是细胞应对应激的重要生存策略。
七、总结与展望
应激诱导的 NELF 核凝聚是细胞转录调控的全新机制,其形成受磷酸化、SUMO 化等翻译后修饰的精密调控,NELFA 的天然无序区则是驱动相分离的结构基础。NELF 通过核凝聚增强与启动子的结合,抑制 Pol II 延伸,实现应激条件下的转录下调,为细胞生存提供保障。这一发现不仅揭示了核凝聚在转录调控中的重要作用,也为理解细胞应激响应的分子网络提供了新的视角,为应激相关疾病的研究提供了潜在的分子靶点。未来研究需进一步探索 NELF 核凝聚与其他核内凝聚物的相互作用,以及不同应激类型下 NELF 调控机制的差异,以完善对细胞应激生存策略的认知。
声明:本篇文章在创作中部分采用了人工智能辅助。如有任何内容涉及版权或知识产权问题,敬请告知,我们承诺将在第一时间核实并撤下。
买重组蛋白,找南京优爱
优爱蛋白专注于提供药物研发、细胞治疗、基因治疗、基础科研所需各种蛋白类试剂原材料和服务,包括药物靶点蛋白、免疫检查点蛋白、细胞因子、工具酶、 蛋白定制表达、全长跨膜蛋白开发等。优爱致力于为客户提供优质的产品和专业服务,打造具有国际竞争力的高新技术企业。
靶点蛋白 | 膜蛋白 | 细胞因子 | 酶 | 病毒抗原 | 蛋白定制
南京优爱生物科技研发有限公司 邮箱:order@ua-bio.com 热线:0571-87565022

产品信息
©2021-2026 南京优爱生物科技研发有限公司版权所有
网站备案号 浙ICP备2022019033号-2 浙公网安备33010202004867号
电话:0571-87565022
邮箱:order@starter-bio.com
本网站销售的所有产品均不得用于人类或动物之临床诊断或治疗,仅可用于工业或者科研等非医疗目的。












