- 最新进展
- 产品信息
最新进展
蛋白质糖基化作为普遍存在的翻译后修饰方式,通过糖链与蛋白质的共价连接,在细胞黏附、分子转运、信号转导等关键生物学过程中发挥核心作用。几乎所有膜蛋白和分泌蛋白均携带糖基化修饰,其中 N - 连接糖基化形成的复杂型、高甘露糖型和杂交型糖链,其结构多样性直接影响生物分子功能。肽 N - 糖苷酶 F(PNGase F)作为解析 N - 连接糖基化的核心工具酶,为糖蛋白质组学研究及疾病机制探索提供了关键支撑。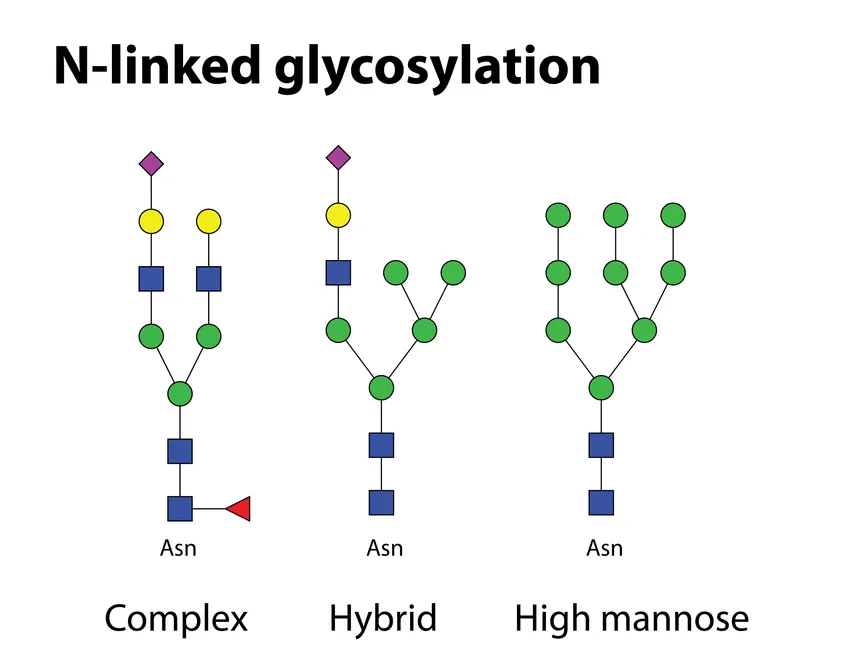

一、蛋白质 N - 连接糖基化修饰的生物学特征
N - 连接糖基化起始于内质网,在高尔基体加工成熟,通过 N - 乙酰葡萄糖胺(GlcNAc)与天冬酰胺残基(位于 Asn-X-Ser/Thr 保守序列)连接。复杂型糖链含岩藻糖、唾液酸等残基,参与细胞识别;高甘露糖型糖链富含甘露糖,调控蛋白质折叠;杂交型糖链兼具两类特征。这种结构多样性赋予蛋白质功能可塑性,如抗体 Fc 段糖基化影响效应功能,肿瘤细胞糖链异常与侵袭转移相关。糖基化模式异常与肿瘤、自身免疫病等密切相关,解析糖链结构是理解疾病机制的重要突破口。
二、PNGase F 的酶学特性与作用机制
PNGase F 是微生物来源的糖苷水解酶,特异性切割 N - 连接糖链与蛋白质的连接键。其作用机制为识别糖链内侧 GlcNAc 与天冬酰胺的酰胺键并水解,同时将天冬酰胺转化为天冬氨酸,完整释放 N - 糖链并保留结构信息。该酶对复杂型、高甘露糖型和杂交型糖链均有高效活性,但核心 GlcNAc 岩藻糖基化会降低催化效率。最适反应条件为 pH 7.0-8.0 和 37℃,在含还原剂和去污剂的缓冲体系中稳定性良好,适用于多种糖蛋白去糖基化处理。
三、PNGase F 在糖蛋白质组学研究中的核心应用
PNGase F 是糖链与蛋白质分离的关键工具,为结构解析和位点鉴定奠定基础。通过酶解释放 N - 糖链后,结合质谱可精确分析糖链分子量、组成及连接方式,构建特定状态下的糖链图谱。如肿瘤研究中,利用 PNGase F 酶解肿瘤分泌糖蛋白,质谱鉴定发现特异性糖链与肿瘤分期相关,有望成为诊断标志物。蛋白质层面,酶解后经胰蛋白酶消化,通过 LC-MS/MS 可鉴定糖基化位点,天冬酰胺转化为天冬氨酸产生的 2 Da 质量偏移,为位点特异性分析提供直接证据。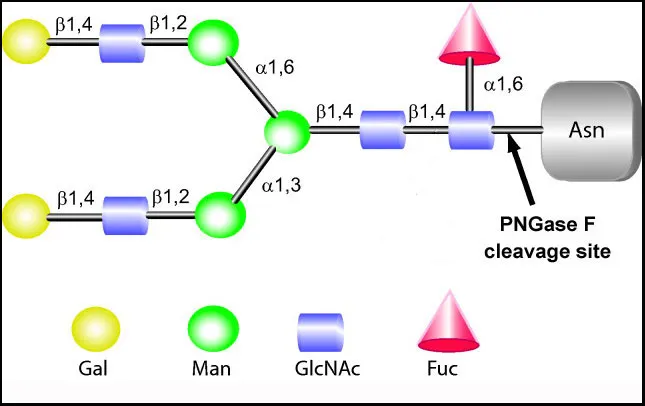

四、PNGase F 在疾病研究与药物开发中的应用价值
肿瘤研究中,PNGase F 辅助分析揭示肿瘤细胞高甘露糖型糖链比例升高,这类异常糖链通过结合免疫细胞受体抑制抗肿瘤免疫,为糖链靶向治疗提供依据。自身免疫病研究发现,IgG 抗体 Fc 段唾液酸化水平降低与疾病活动度相关,为诊断提供新指标。生物制药领域,PNGase F 用于重组糖蛋白药物质量控制,通过质谱分析糖链组成和均一性,确保疗效与安全性。酶解处理还利于蛋白质结晶和结构解析,支持糖蛋白药物优化。
五、PNGase F 的技术优势与研究展望
PNGase F 具有底物范围广、效率高、特异性强的优势,满足高通量研究需求。与稳定同位素标记结合可实现糖链定量分析,自动化酶解系统提升处理效率,推动糖蛋白质组学规模化发展。未来需优化反应条件,拓展对核心岩藻糖基化等抗性糖链的酶解能力。结合单细胞和空间蛋白质组学技术,有望在单细胞水平揭示糖链异质性,为理解糖基化动态调控机制提供新视角,不断拓展其在生命科学和生物医药中的应用边界。
产品信息













