- 最新进展
- 产品信息
一、什么是MHC四聚体技术?它的诞生解决了怎样的科学难题?
在免疫学研究的漫长历程中,如何精确地识别、定量并分离那些针对特定抗原(如病毒肽段、肿瘤新抗原)的特异性T细胞,一直是一个巨大的技术挑战。在20世纪90年代之前,研究人员主要依赖于功能学 assay,如有限稀释法(LDA)或酶联免疫斑点(ELISPOT)来间接估算特异性T细胞的数量。这些方法通过观察T细胞在受到抗原刺激后产生的增殖反应或细胞因子(如IFN-γ)的分泌来推断其存在和功能。然而,这些功能学方法存在固有的局限性:它们无法提供T细胞表面T细胞受体(TCR)的直接信息,无法区分记忆T细胞和效应T细胞的状态,并且其灵敏度有限,难以检测频率极低(<0.01%)的抗原特异性T细胞群体。更重要的是,功能检测依赖于细胞的活性,在检测过程中细胞可能发生凋亡、分化或改变其功能状态,从而无法真实反映体内初始的T细胞库情况。
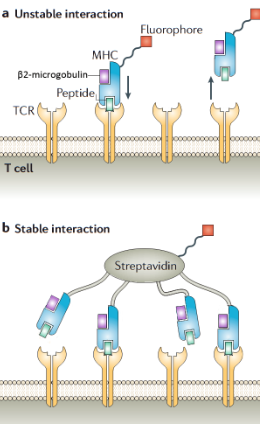
这一困境在1996年被美国NIH的John Altman和Mark Davis等人彻底打破。他们受启发于链霉亲和素(Streptavidin)一个分子可以高亲和力地结合四个生物素(Biotin)分子的特性,创造性地将这一化学系统应用于免疫学检测,发明了MHC四聚体技术。其核心原理是:首先,通过基因工程手段生产目标MHC-I类分子(如HLA-A*02:01)的重链和轻链(β2微球蛋白);然后,将重链的胞外段与 BirA 酶的特异性底物序列(BirA substrate peptide)融合,以便在体外实现位点特异性的生物素化。接着,在存在特定抗原肽段和β2微球蛋白的条件下,使生物素化的MHC重链正确折叠,形成稳定的pMHC复合物。最后,将四个相同的pMHC单体分子与一个荧光素标记的链霉亲和素通过生物素-亲和素系统耦联,形成一个荧光标记的、四价的pMHC复合物,即MHC四聚体。这个四聚体结构能够以高亲和力、高特异性地与表面表达对应TCR的T细胞结合,其结合力远强于单价或双价的pMHC与TCR的相互作用,从而实现了在流式细胞仪上直接“看见”并分选这些特异性T细胞。这项技术的诞生,如同为免疫学家提供了一副能够直接观察T细胞免疫应答“庐山真面目”的高精度眼镜,标志着T细胞免疫学研究从此进入了直接 ex vivo 检测的全新时代。
二、HLA-A MHC四聚体的制备流程是怎样的?其中有哪些关键的技术要点?
构建一个高效、特异且稳定的HLA-A MHC四聚体是一个精细且多步骤的生化过程,其每一个环节都至关重要,直接影响最终产品的质量和实验结果的可信度。整个流程始于基因克隆与蛋白表达。研究人员需要首先获取目标HLA-A等位基因(例如在人群中广泛存在的HLA-A*02:01)胞外段(α1, α2, α3结构域)的编码序列,并将其克隆到原核(如大肠杆菌)或真核(如昆虫细胞-杆状病毒系统)表达载体中。关键的一点是,必须在HLA重链的C末端融合一段约15个氨基酸的BirA酶催化序列,这是实现高效、位点特异性生物素化的前提。β2微球蛋白的基因通常单独克隆和表达。将构建好的载体导入表达系统进行大量表达,随后通过包涵体复性或直接从细胞培养上清中纯化获得可溶性的重组蛋白。
获得纯化的HLA重链、β2微球蛋白和合成的抗原肽段后,下一步是进行pMHC单体的折叠与纯化。这是一个非常精细的步骤,需要将三者以精确的摩尔比在优化的氧化还原缓冲液(通常含有精氨酸等辅助折叠的试剂)中共同孵育,促使它们正确折叠形成稳定的pMHC复合物。未正确折叠的蛋白聚集体和多余的肽段需要通过分子筛层析(Size-exclusion chromatography, SEC)或离子交换层析等技术去除,以获得高纯度的pMHC单体。紧接着是生物素化反应,利用BirA酶在ATP存在的条件下,特异性地将生物素共价连接到HLA重链C末端的BirA序列所包含的特异性赖氨酸残基上。酶促反应的效率必须通过电泳或HABA法进行严格监测,确保生物化效率接近100%,因为未生物素化的单体无法形成四聚体,会成为后续检测中的背景噪音来源。
最后一步是四聚体的组装。将生物素化的pMCM单体与带有荧光标签(最常用的是PE,藻红蛋白,因其亮度极高)的链霉亲和素按略高于4:1的摩尔比混合,冰上避光孵育。链霉亲和素的四个生物素结合位点会“捕获”四个pMHC单体,自发地组装成荧光标记的MHC四聚体。过量单体会通过进一步的凝胶过滤层析去除,最终得到即用型的、高度均一的HLA-A MHC四聚体试剂,可于-80°C长期保存。整个流程对蛋白的质量、折叠效率、生物素化效率以及组装比例的控制都要求极高,是分子生物学、生物化学和免疫学技术的集中体现。
三、这一技术在基础与临床研究中有哪些革命性的应用?
HLA-A MHC四聚体技术的出现,极大地推动了从基础免疫学到临床免疫治疗的几乎所有相关领域的进步。在基础研究方面,它成为了解密适应性免疫应答动态过程的“终极工具”。研究人员能够直接在外周血、淋巴结或肿瘤浸润淋巴细胞(TILs)中,追踪在病毒感染(如HIV、CMV、EBV、流感)、自身免疫病或肿瘤发生发展过程中,抗原特异性CD8+ T细胞群的频率、表型(如记忆亚型:初始T细胞、中央记忆T细胞、效应记忆T细胞、终末效应T细胞)、功能状态(通过联合细胞内因子染色)和TCR库多样性的精确变化。这使得绘制T细胞免疫应答的完整图谱成为可能,例如揭示了在急性感染中T细胞反应的扩增、收缩和形成记忆库的动力学过程,以及在慢性感染和癌症中T细胞功能耗竭(Exhaustion)的详细特征。
在疫苗研发领域,四聚体技术是评估疫苗免疫原性的金标准。传统的抗体滴度测量只能反映体液免疫的效果,而一款有效的疫苗,尤其是旨在预防病毒感染或治疗癌症的疫苗,其成功的关键在于能否诱导出强大而持久的特异性T细胞免疫。利用四聚体技术,研究人员可以精确量化接种疫苗后体内产生的抗原特异性CD8+ T细胞的数量和质量,从而为疫苗候选物的筛选和优化提供最直接、最可靠的免疫学依据。
在肿瘤免疫学和过继性细胞治疗(ACT) 中,四聚体技术的作用更是不可或缺。它被广泛用于鉴定和筛选针对肿瘤新生抗原(Neoantigens)或肿瘤相关抗原(TAAs)的特异性T细胞克隆。研究人员可以从患者体内分离出这些稀有但具有强大抗癌潜力的T细胞,在体外进行扩增,再回输到患者体内,即TILs疗法或TCR-T细胞疗法。在整个治疗过程中,四聚体被用于监控回输的T细胞在患者体内的持久性、分布以及功能状态,是评估治疗效果和预测预后的关键生物标志物。此外,在自身免疫性疾病研究中,四聚体技术帮助识别了那些错误地攻击自身组织的致病性T细胞克隆,为理解疾病机制和开发靶向清除这些致病克隆的新疗法开辟了道路。
四、尽管强大,MHC四聚体技术目前面临哪些主要挑战与局限性?
尽管MHC四聚体技术带来了革命性的突破,但它并非完美无缺,其应用仍面临着 several 重要的挑战和局限性。首要的挑战是其高度的HLA限制性。四聚体是基于特定的HLA等位基因(如HLA-A*02:01)构建的,因此只能检测识别由该等位基因呈递的特定抗原肽的T细胞。由于HLA系统具有极端的多样性,不同人种和个体间基因型差异巨大,这意味着需要为不同的HLA类型和不同的抗原肽段单独设计和生产四聚体,成本高昂且流程繁琐,在很大程度上限制了其大规模、无偏的筛查应用。
其次,是TCR亲和力的影响。四聚体与T细胞的结合依赖于pMHC与TCR相互作用的亲和力。对于亲和力非常低的TCR,即使其具有生物学功能(能够被抗原激活),也可能无法形成稳定的结合,导致假阴性结果。反之,极高亲和力的交叉反应也可能导致假阳性。此外,T细胞的激活状态也会影响结合:某些激活后的T细胞可能会发生TCR内化或表面分子表达变化,影响四聚体染色效率。
第三,在检测低频T细胞群体时,背景噪音是一个问题。尤其是在分析表型复杂的样本(如肿瘤组织)时,非特异性结合或死细胞的荧光信号可能会掩盖那些频率极低的真正抗原特异性T细胞信号,对仪器的灵敏度和数据分析策略提出了极高要求。
最后,传统的四聚体技术是一种“靶向性”技术,它只能用于检测已知抗原的已知T细胞,而无法发现和鉴定未知的新抗原或全新的TCR特异性,即“非假设驱动”的发现能力较弱。为了克服这些局限性,一系列新技术应运而生,如基于编码多种pMHC的DNA条形码技术的高通量筛选平台,允许在一次实验中同时筛查T细胞对数百甚至数千种抗原的反应,大大扩展了四聚体技术的应用边界。
五、未来的发展方向是什么?新技术如何进一步拓展其潜力?
为了突破传统四聚体技术的瓶颈,科学家们正在从多个方向推动该技术的迭代升级。一个核心的方向是多重化与高通量化。基于质谱流式(CyTOF)的金属标签四聚体,或基于荧光条形码(Barcoding)的多重pMHC四聚体组合技术,使得同时检测一个样本对几十种甚至上百种不同抗原的特异性T细胞响应成为现实。这极大地提高了检测效率,降低了样本量需求,并允许绘制出极其精细的T细胞免疫应答全景图。
另一个前沿方向是功能性与动态检测的结合。将四聚体染色与检测细胞因子分泌、增殖能力、杀伤活性以及转录组和蛋白组分析相结合,能够超越单纯的“计数”,深入揭示这些被识别出的T细胞的功能特性、分化轨迹和代谢状态,为评估免疫细胞的质量提供了多维度的信息。
此外,新结构设计也在探索中。例如,利用更小的荧光标签或新型荧光纳米材料来降低背景;开发可被特定条件下切割的“可解离”四聚体,以解决高亲和力四聚体可能 artificially 激活或干扰T细胞功能的问题;以及设计MHC-II类四聚体以更好地研究CD4+ T细胞应答。
展望未来,HLA-A MHC四聚体技术作为免疫学研究的一座里程碑,其核心原理将继续是解密T细胞免疫的基石。它与单细胞测序、CRISPR筛选、生物信息学等前沿技术的深度融合,必将持续推动我们在感染免疫、肿瘤免疫、自身免疫病以及疫苗设计等领域取得更深层次的理解和更突破性的临床进展,最终为实现精准免疫监测和个性化免疫治疗奠定坚实的技术基础。
点击下方的产品货号,直达官网详情页供您了解













