- 最新进展
- 产品信息
- 参考文献
一、什么是IL-7?
IL-7是一种由IL7基因编码的、分子量约为25 kDa的可溶性分泌蛋白。其受体IL-7R属于异源二聚体复合物,由IL-7Rα链和公共γ链(γc)组成,后者亦被IL-2、IL-4、IL-9、IL-15及IL-21等多种白细胞介素的受体所共用。IL-7与IL-7R所介导的信号通路在T细胞发育、B细胞生成(尤其在小鼠)、幼稚T细胞分化与存活,以及记忆T细胞的生成与维持中扮演核心角色。随着更多固有淋巴细胞(ILC)家族成员的发现,IL-7被证实对多种ILC亚群的发育与稳态维持、淋巴结构的形成及屏障免疫功能的调节亦至关重要。此外,该通路还广泛参与多种淋巴功能异常相关疾病的发病机制。本文将系统综述IL-7/IL-7R信号的生理与病理功能,并探讨靶向该通路在疾病治疗中的潜力与前景。
二、IL-7及其受体在哪些组织和细胞中表达?
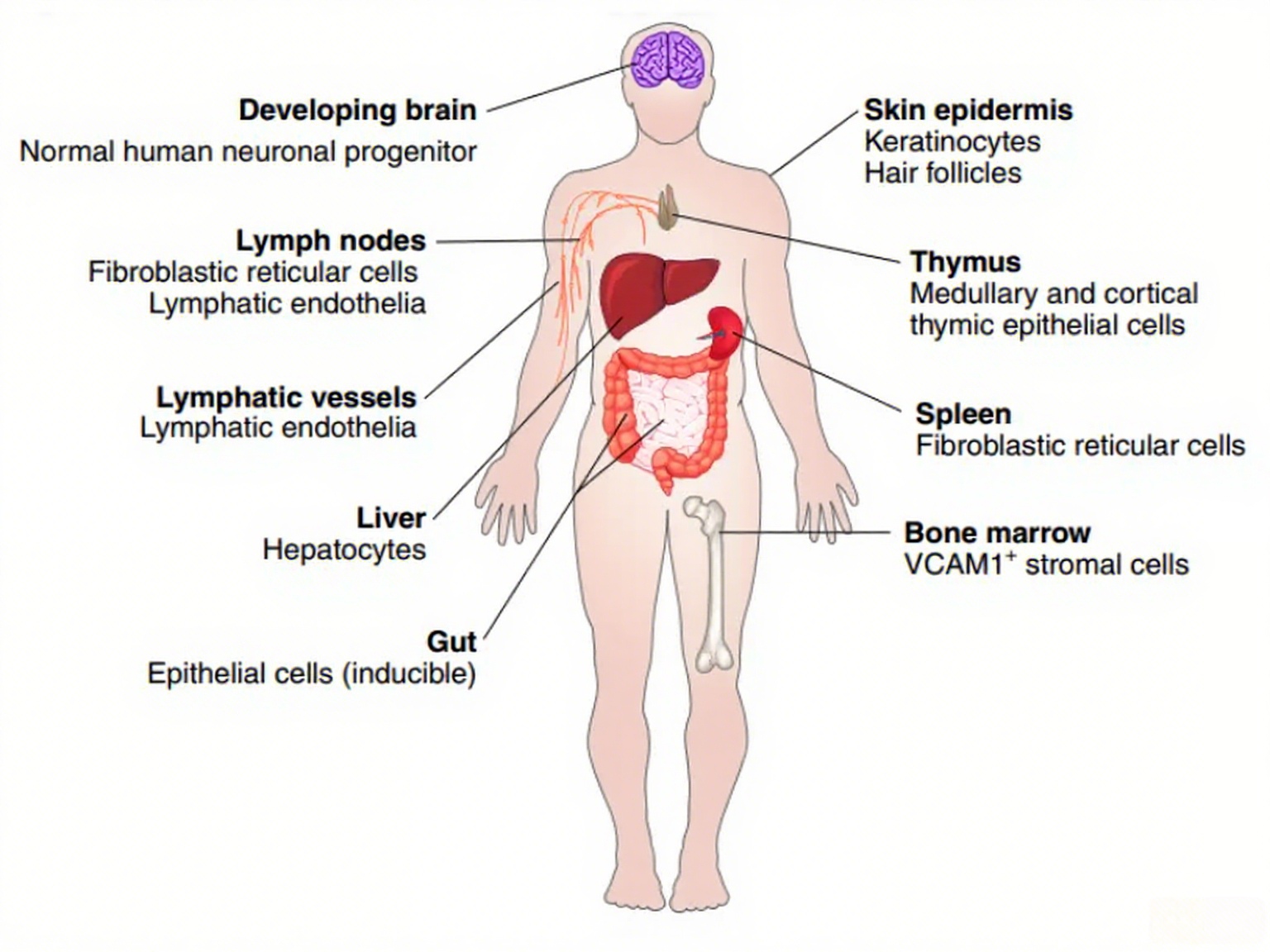
IL-7 mRNA最初在胸腺中被发现,后续研究证实其在多种组织中广泛表达。淋巴器官如胸腺和淋巴结中表达水平最高,在非淋巴组织如肠道、肺、肝脏和皮肤中亦能检测到明显表达。
从细胞来源看,IL-7主要源自非造血细胞。胸腺上皮细胞(TECs)和成纤维网状细胞(FRCs)是淋巴结中IL-7的重要生产者。皮肤中的角质形成细胞可组成性表达IL-7,而肠上皮细胞中其表达可受IFN-γ信号诱导。此外,大脑中的神经元前体细胞也被报道可产生IL-7。
IL-7Rα的表达则广泛分布于淋巴系统,包括B祖细胞、各类ILC以及T细胞发育全程。新近研究还发现其在胎儿来源的巨噬细胞发育过程中表达。在非造血细胞中,淋巴管内皮细胞也表达IL-7Rα,并参与三级淋巴结构形成过程中的淋巴管扩张。
三、IL-7如何调控淋巴系统的发育?
IL-7缺陷小鼠研究明确显示,IL-7信号对T细胞、B细胞及ILC的发育与维持不可或缺。
在B淋巴细胞方面,IL-7是小鼠B细胞从共同淋巴祖细胞(CLP)向祖B细胞及成熟B细胞发育的关键因子,决定其向B系而非T系分化。然而,人类B细胞发育对IL-7的依赖较弱。
胸腺中的淋巴祖细胞需依赖IL-7信号以支持其增殖与分化。胸腺自然杀伤(NK)细胞相比传统NK细胞更依赖IL-7。在前体T细胞阶段,CD4⁻CD8⁻双阴性(DN)细胞从DN2向γδ T细胞的分化完全依赖于IL-7,该过程涉及如CD98等细胞生长相关基因的上调。至CD4⁺CD8⁺双阳性(DP)阶段,IL-7R表达下降,该群体不再依赖IL-7信号。在ILC中,IL-7对ILC2与ILC3的发育尤为关键,缺失IL-7将导致这些亚群完全缺失。
四、IL-7在免疫稳态中发挥什么作用?
IL-7R在幼稚T细胞和记忆T细胞中持续表达,通过调控内在凋亡途径促进其长期存活,对维持T细胞稳态至关重要。
T细胞活化后迅速下调IL-7Rα,其表达维持依赖于转录因子Foxo1的活性,后者受Akt/PI3K通路负调控——该通路可由TCR或IL-2信号激活。这一机制使效应T细胞从IL-7依赖的稳态调控中解离,转而依赖TCR与IL-2信号以维持生存与增殖。
在免疫应答后期,部分效应T细胞重新表达IL-7Rα,进而分化为长期记忆T细胞,表明IL-7信号在记忆前体细胞的形成中起指导作用。此外,ILC的存活也高度依赖IL-7,进一步巩固了其在免疫稳态中的核心地位。
五、IL-7/IL-7R异常与哪些疾病相关?
正常的IL-7/IL-7R信号对免疫平衡至关重要,但其异常表达则与多种免疫疾病及恶性肿瘤密切相关。
在自身免疫性疾病中,IL-7信号过度激活可促进自身反应性T细胞扩增,与I型糖尿病、多发性硬化(MS)、类风湿关节炎、强直性脊柱炎及炎症性肠病等相关。MS患者脑脊液和原发性干燥综合征(pSS)患者唾液腺中均检测到IL-7/IL-7R的高表达,且与疾病严重程度正相关。全基因组关联分析(GWAS)发现IL7R基因座的单核苷酸多态性(SNPs)与自身免疫病易感性相关,部分单倍型导致可溶性IL-7R水平上升,但其具体致病机制尚未完全阐明。
在肿瘤方面,IL-7Rα过表达或功能增益突变与多种白血病相关。儿童B细胞急性淋巴细胞白血病(B-ALL)复发与IL-7Rα过表达有关;部分前体B细胞ALL患者携带导致配体非依赖性激活的IL-7Rα突变。在T细胞ALL(T-ALL)中,IL-7信号促进肿瘤进展,约10%的患者存在IL-7Rα突变,使其成为潜在治疗靶点。值得注意的是,尽管多数研究支持IL-7的抗肿瘤免疫作用,亦有报道提示其可能在某些语境(如非小细胞肺癌)中促进肿瘤发展,具体角色需进一步研究明确。
结语
作为一类重要的细胞因子,IL-7通过与其受体IL-7R结合,在淋巴细胞发育、免疫稳态维持及屏障防御中发挥核心作用。该通路的异常激活参与自身免疫病、慢性炎症及白血病的发生发展。随着机制研究的深入及临床数据的积累,调控IL-7信号通路有望为更多患者带来获益。
1.Nature Immunology(2019) 20: 1584–1593
2.Journal of Interferon & Cytokine Research (2022) 42(6): 243–250
3.Frontiers in Immunology (2020) 11: 1557













