2025年诺贝尔生理学或医学奖:解码免疫稳态的守护者——调节性T细胞(Tregs)
2025年10月6日北京时间17时30分许,诺贝尔奖委员会宣布,将本年度的生理学或医学奖授予美国科学家玛丽·E·布伦科、弗雷德·拉姆斯德尔以及日本科学家坂口志文,以表彰他们在“外周免疫耐受方面的发现”。
- 最新进展
- 产品信息
引言:健康平衡的免疫奥秘
2025年10月6日北京时间17时30分许,诺贝尔奖委员会宣布,将本年度的生理学或医学奖授予美国科学家玛丽·E·布伦科、弗雷德·拉姆斯德尔以及日本科学家坂口志文,以表彰他们在“外周免疫耐受方面的发现”。这一发现的核心,正是免疫系统中一群功能独特的细胞——调节性T细胞。他们的工作不仅颠覆了传统免疫学认知,更为我们理解、干预一系列重大疾病提供了全新的理论基石与治疗范式。本文将深入探讨Tregs的生物学特性、其发现历程、分子调控机制及其广阔的临床应用前景,阐明其为何成为当今免疫学研究的核心与2025年诺贝尔奖的焦点。

一、免疫系统如何实现精妙的“攻防平衡”?——从“军事学院”到“前线维和”的范式转变
传统免疫学理论,即“中枢免疫耐受”模型,将胸腺比作一座严格的“军事学院”。在这里,发育中的T细胞需经历“负选择”的残酷筛选:任何表达能识别自身组织抗原的T细胞受体(TCR)的T细胞,都将被诱导凋亡,从而在源头上清除潜在的“自身反应性”或“危险分子”T细胞。这一理论长期主导着学界对自身免疫耐受的理解。
然而,这一模型存在固有局限。首先,并非所有自身抗原都能在胸腺中充分呈现以供筛选;其次,总有部分自身反应性T细胞能够“逃逸”胸腺的审查,进入外周循环。那么,机体是如何防止这些“漏网之鱼”在外周器官中激活并攻击自身,从而导致自身免疫病的发生呢?这正是三位诺奖得主所解决的核心科学问题。
他们的研究共同揭示了一个更为精细、主动的免疫调控层级:外周免疫耐受。该机制指出,即便存在自身反应性T细胞,在健康个体中,它们也通常处于一种被严密监控的“无能”或“静息”状态。而执行这一“前线维和”任务的核心执行者,便是调节性T细胞。Tregs的发现,标志着免疫学认知从单纯的“清除异己”向复杂的“动态平衡”理念的深刻转变。
二、谁是免疫系统的“终极刹车”?——调节性T细胞的发现与身份鉴定
Tregs概念的最终确立,是一部跨越三十年的科学“探案史”,其线索源于一个几乎被遗弃的假说。
- 历史雏形与理论困境:
早在20世纪70年代,就有学者基于实验观察提出了“抑制性T细胞”的存在,认为某些T细胞能够主动抑制其他免疫细胞的活性。然而,由于当时技术所限,无法精确分离和表征这群细胞,且其分子机制不明,到了80年代,这一概念因缺乏直接证据而逐渐被主流学界质疑并近乎抛弃。 - 坂口志文的决定性证据:
在“抑制性T细胞”理论式微的背景下,日本科学家坂口志文选择了逆流而上,坚持探索。1995年,他发表了里程碑式的研究。他通过精细的细胞分选技术,特异性地将小鼠体内一群表达CD25(白细胞介素-2受体α链)分子的CD4+ T细胞移除。随后,当他将剩余的、缺乏这群细胞的免疫系统移植给免疫缺陷小鼠时,受体小鼠迅速发展出多种致命的自身免疫性疾病。这一实验雄辩地证明,CD4+CD25+ T细胞群体在体内确实扮演着不可或缺的“抑制性”角色,是维持免疫稳态的活性成分。尽管证据有力,这一发现在当时仍面临不少怀疑与挑战。 - 布伦科与拉姆斯德尔的基因破译:
几乎在同一时期,另一条关键线索在大洋彼岸浮现。玛丽·布伦科与弗雷德·拉姆斯德尔在研究一种名为“scurfy”的X连锁隐性遗传突变小鼠模型时,发现该品系小鼠在出生后不久便会因全身性、灾难性的淋巴细胞浸润及多器官自身免疫炎症而死亡。这一表型强烈提示,存在一个对免疫系统行使负向调控的关键基因发生了突变。经过数年的艰苦努力,他们于2001年成功定位并克隆了该致病基因,命名为_Foxp3_。_Foxp3_被证实编码一个属于forkhead/winged-helix转录因子家族的蛋白质。 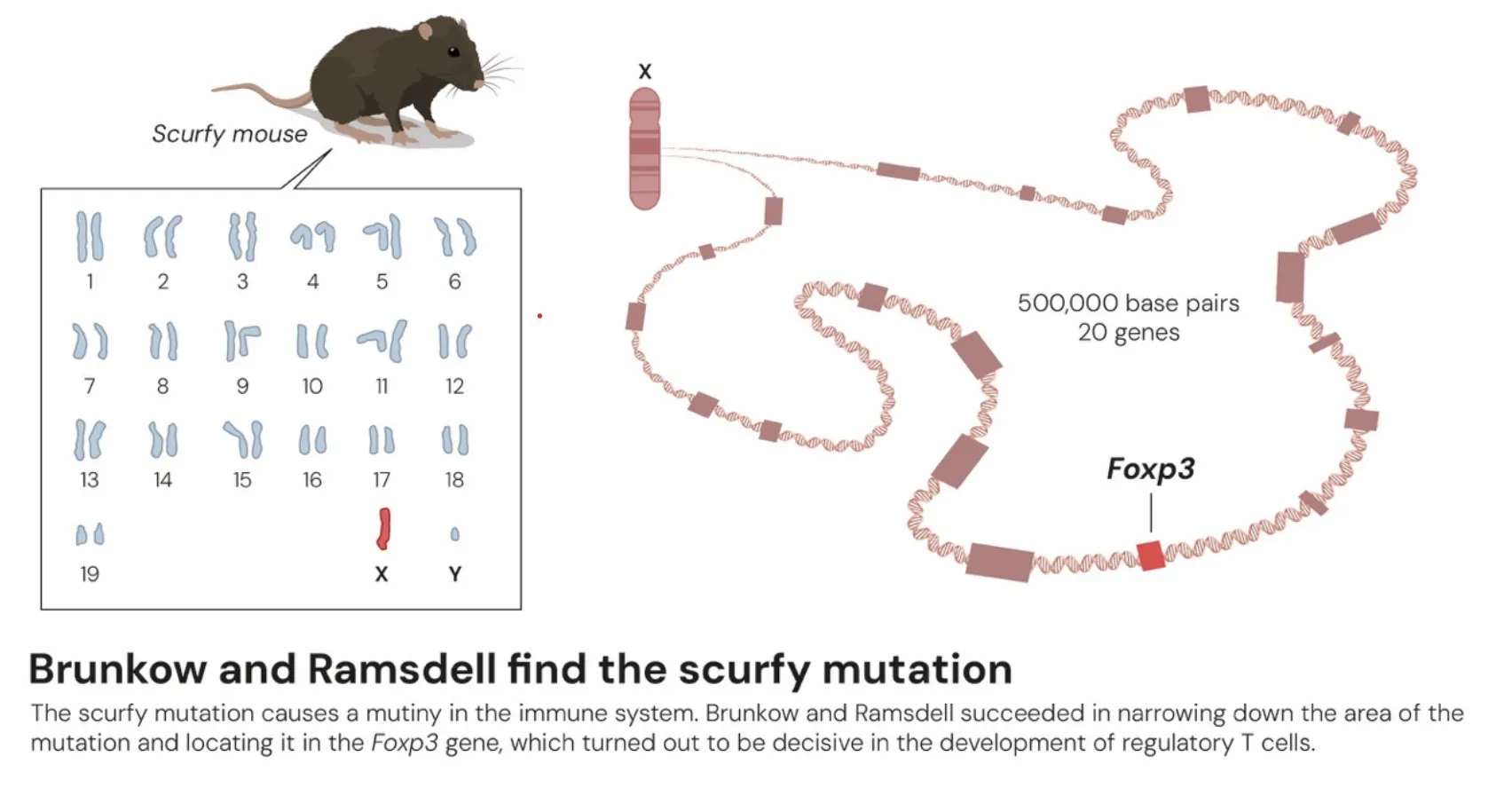
- 伟大的统一:Foxp3作为Tregs的“主控开关”
最终的理论整合在2003年由坂口志文团队完成。他们将两条独立的线索完美衔接,证实了_Foxp3_基因正是他所发现的CD4+CD25+ 调节性T细胞功能所必需的。后续研究进一步揭示,Foxp3并非普通基因,它是Tregs细胞谱系定向分化、维持其稳定及发挥抑制功能的“主控开关”或“总司令”。Foxp3的表达对于赋予T细胞调节特性至关重要,其缺失或突变将直接导致Tregs的发育缺陷或功能丧失,进而引发严重的自身免疫病理。至此,一个完整的科学图景得以呈现:一群具有特定表型(CD4+CD25+)和独特分子标记(Foxp3+)的专职免疫抑制性细胞——调节性T细胞,被正式确立为外周免疫耐受的核心执行者。
三、Tregs如何行使“维和”职能?——其分子作用机制探秘
Tregs通过多种机制,以接触依赖和非接触依赖的方式,对效应性T细胞、抗原呈递细胞、自然杀伤细胞等多种免疫细胞施加抑制作用,从而维持免疫耐受与稳态。
- 细胞因子介导的抑制:Tregs能够组成性表达高水平的IL-2受体(CD25),通过“窃取”微环境中的IL-2,剥夺效应T细胞生长所必需的细胞因子,从而抑制其增殖。此外,Tregs能大量分泌抑制性细胞因子,如转化生长因子-β(TGF-β)和白细胞介素-10(IL-10)。TGF-β能直接抑制T细胞活化和增殖,而IL-10则对抗原呈递细胞的功能具有强烈的抑制作用,间接削弱免疫应答。
- 细胞接触依赖性机制:Tregs表面表达CTLA-4,该分子与抗原呈递细胞表面的CD80/CD86结合的亲和力远高于CD28,能有效竞争性抑制共刺激信号,甚至可诱导CD80/CD86的内吞与降解,使抗原呈递细胞“失能”,无法有效激活T细胞。此外,Tregs还能通过颗粒酶/穿孔素途径直接杀伤活化的效应T细胞。
- 代谢干扰:Tregs高表达CD39和CD73等外核苷酸酶,能将细胞外的ATP/ADP水解为腺苷。腺苷通过与效应T细胞表面的A2A受体结合,启动抑制性信号通路,抑制T细胞的活化与细胞因子产生。这种通过调控局部微环境代谢物来行使功能的方式,是Tregs作用机制的重要一环。
四、从基础发现到临床革新:Tregs如何成为疾病治疗的“双刃剑”?
对Tregs生物学功能的深刻理解,催生了两种策略截然相反、却又同样前景广阔的免疫治疗新范式。
- 增强Tregs功能:为过度攻击的免疫系统“踩刹车”
在自身免疫性疾病(如1型糖尿病、类风湿关节炎、多发性硬化症、系统性红斑狼疮等)以及器官移植后的排斥反应中,核心问题是免疫系统对自身抗原或移植物抗原的攻击失控。因此,治疗策略旨在增强Tregs的抑制功能或增加其数量。
- 低剂量IL-2疗法:鉴于Tregs高表达IL-2受体,使用极低剂量的重组IL-2可以选择性地激活和扩增体内的Tregs,而不显著激活效应T细胞,已在某些自身免疫病(如自身免疫性血管炎、移植物抗宿主病)的临床试验中显示出疗效。
- Tregs过继细胞疗法:从患者体内分离出自体Tregs,在体外进行扩增和功能优化,然后回输到患者体内,以增强其免疫抑制能力。这在1型糖尿病和实体器官移植的临床研究中已取得初步成功。
- 靶向抗原特异性Tregs诱导:通过口服或鼻腔给药特定抗原,或使用修饰后的肽段配体,诱导机体产生针对该特定抗原的“抗原特异性Tregs”,实现更精准、局部的免疫抑制,避免全身性免疫抑制的副作用。
- 抑制Tregs功能:为抗癌免疫“松开刹车”
在肿瘤微环境中,情况则截然相反。狡猾的肿瘤细胞能够通过分泌趋化因子(如CCL22)和细胞因子(如TGF-β、IL-10),主动招募Tregs至肿瘤部位,并诱导其扩增和活化。这些肿瘤浸润性Tregs成为肿瘤的“保镖”,强力抑制杀伤性T细胞(CTL)和NK细胞等对肿瘤细胞的识别与攻击,是肿瘤免疫逃逸的关键机制之一。因此,抗癌的新策略便是设法在肿瘤局部暂时性地清除或抑制Tregs的功能。
- 抗CTLA-4抗体:如伊匹木单抗(Ipilimumab),其作用机制之一便是通过Fc受体介导的抗体依赖性细胞毒性作用(ADCC),选择性清除肿瘤微环境中的Tregs,从而解除免疫抑制。
- 抗CCR4抗体:CCR4是Tregs表面高表达的趋化因子受体,靶向CCR4的抗体(如Mogamulizumab)可阻断Tregs向肿瘤的募集,并可通过ADCC效应清除循环中的CCR4+ Tregs。
- 靶向Tregs稳定性:研究正在探索如何干扰Tregs内Foxp3的表达或稳定性,使其在炎症性的肿瘤微环境中“去稳定化”,从而失去抑制功能,甚至转化为效应性T细胞。
结论与展望
2025年诺贝尔生理学或医学奖所表彰的,不仅仅是对一类新细胞的发现,更是对一个根本性生物学原理的揭示:健康依赖于免疫系统攻击力与抑制力之间精妙的动态平衡。调节性T细胞作为这一平衡的核心调节者,其发现是免疫学领域的一座里程碑。从坂口志文对“抑制性T细胞”假说的实验证实,到布伦科与拉姆斯德尔对关键调控基因_Foxp3_的破译,再到最终理论的统一,这一历程完美体现了基础科学研究的持久价值与颠覆性力量。
如今,以Tregs为靶点的治疗策略已形成一个庞大且快速发展的研发领域。全球范围内有超过200项相关的临床试验正在进行,涵盖了从自身免疫病、过敏、移植排斥到癌症的众多疾病谱。未来,如何实现对Tregs更精准、时空可控的调控,如何区分不同组织来源、不同亚群的Tregs功能,以及如何将Tregs疗法与其他治疗手段(如检查点抑制剂、CAR-T等)有机结合,仍是科学家们面临的挑战与机遇。毋庸置疑,对Tregs的深入研究将继续引领免疫治疗的下一次革命,为无数患者带来新的希望。













