- 最新进展
- 产品信息
树突状细胞作为免疫系统的“哨兵”与“司令”,是连接天然免疫与适应性免疫的核心桥梁。其中,骨髓来源的树突状细胞因其易于大量获得、可定向诱导分化,已成为体外研究DC生物学、抗原呈递、T细胞激活及免疫调控的黄金标准模型。
面对不同的科研目标——是需要激发强大的T细胞反应,还是研究免疫耐受机制?选择正确的细胞因子组合是成功的关键。本篇指南将化繁为简,深度剖析如何利用细胞因子套装,在体外高效诱导出功能特异的小鼠BMDC。
第一部分:理论基石——理解BMDC的两大分化路径
小鼠骨髓前体细胞在体外主要可被诱导分化为两大类功能迥异的DC:
常规DC: 由GM-CSF驱动分化。这类细胞高表达MHC II类分子和共刺激分子(CD80, CD86),具有强大的抗原呈递能力,能有效激活初始T细胞,是研究炎症、感染和抗癌免疫中最常用的模型。
浆细胞样DC: 由Flt3-Ligand驱动分化。这类细胞以大量产生I型干扰素为特征,在抗病毒免疫和某些自身免疫病中发挥核心作用。
第二部分:核心武器库——驱动BMDC分化的核心信号通路
细胞因子本身是“信使”,而信号通路是细胞内的“指令执行系统”。以下是诱导BMDC中最关键的几条通路:
JAK-STAT信号通路
这是绝大多数细胞因子发挥作用的核心通路。
作用模式:细胞因子(如GM-CSF, IL-4, Flt3-L)与细胞膜表面的受体结合,导致受体构象改变,激活与其相关联的JAK激酶。活化后的JAK磷酸化受体,为STAT蛋白提供停泊位点。STAT蛋白被磷酸化后,形成二聚体,转入细胞核内,作为转录因子直接调控特定基因的表达。
举例:GM-CSF主要通过JAK2/STAT5通路驱动髓系前体细胞向cDC分化。
NF-κB信号通路
这是DC成熟过程的“主控开关”。
作用模式:成熟刺激信号(如LPS通过TLR4,TNF-α通过其受体)可激活IKK复合物,进而磷酸化降解IκB蛋白,使NF-κB二聚体(如p65/p50)得以释放并进入细胞核,启动大量促炎细胞因子(TNF-α, IL-6, IL-12)、趋化因子和共刺激分子(CD80, CD86)的基因转录。
MAPK信号通路
协同调节细胞增殖、存活和炎症反应。
作用模式:同样由多种刺激(包括生长因子、应激、LPS)激活,包括ERK、JNK、p38等分支。在DC中,p38 MAPK通路对IL-12的产生至关重要。
第三部分:实战方案——小鼠BMDC诱导分化方案
- 小鼠骨髓细胞获取
1.1 将6-8周龄小鼠颈椎脱臼法处死,取股骨,去除骨周围的肌肉组织。
1.2 用75%酒精浸泡消毒股骨2分钟,PBS清洗2次。
1.3 用剪刀剪去股骨两端,用注射器抽取PBS,针头从骨两端插入骨髓腔,反复冲洗直至骨变白。
1.4 收集骨髓悬液,用200目尼龙网过滤。
1.5 滤液1200rpm离心5分钟,弃上清。
1.6 加入2ml 红细胞裂解液,室温裂解3-5分钟。
1.7 加入10ml PBS,1200rpm离心5分钟。
1.8 弃上清,加入PBS清洗1次,用10%FBS的1640培养基重悬细胞。 - BMDC诱导
2.1 用培养基将细胞密度调整为1e6/mL,同时加入GM-CSF (UA040056) (20ng/mL)和IL-4 (UA040192) (20ng/mL),此为D0。
2.2 每2天进行半换液,即取出半量培养基,离心收集悬浮细胞,用等体积的培养基重悬,并补充相应浓度的细胞因子后加入皿中。
2.3 D6收集悬浮细胞和贴壁细胞,1200rpm离心5分钟,弃上清将细胞密度调整为1e6/mL,同时加入GM-CSF (20ng/mL)和IL-4 (20ng/mL),此为不完全成熟的BMDC。
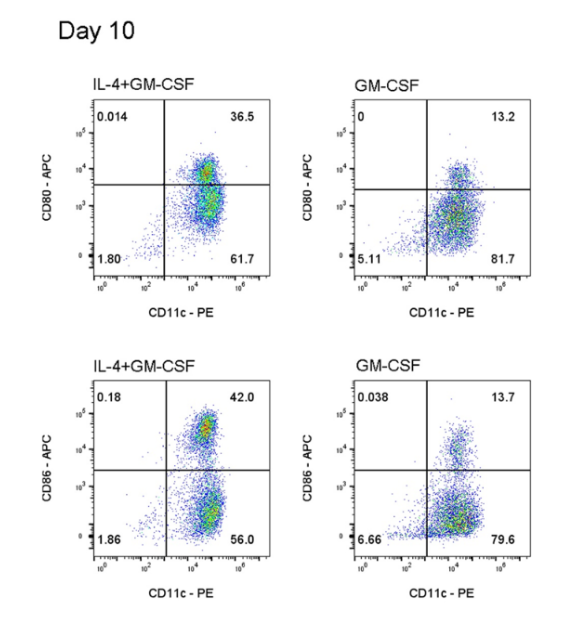
2.4 BMDC的完全成熟:在D8加入TNF-α (20ng/mL),GM-CSF (20ng/mL)和IL-4 (20ng/mL),D10收集悬浮细胞和贴壁生长的细胞。
3.不完全成熟BMDC检测
3.1 收集细胞:细胞因子干预后,弃培养基上清,用PBS清洗细胞1遍,弃上清,再将贴壁细胞用PBS轻轻吹打重悬。
3.2 计数:用细胞计数仪计数并计算细胞总数,并将按照1e7/mL重悬。
3.3 细胞封闭:100μl/孔加至96孔板或流式管中,并加入Mouse IgG (Mouse FcR Blocking Reagent),4℃孵育30min,300Xg 离心5min,弃上清。
3.4 孵育抗体:各加入以下抗体,4℃孵育30min,300Xg 离心5min,弃上清。
组1:PE anti-mouse CD11c Antibody (117307) (抗体用量参考说明书)
APC anti-mouse CD80 Antibody (104713) (抗体用量参考说明书)
组2:PE anti-mouse CD11c Antibody (117307) (抗体用量参考说明书)
APC anti-mouse CD86 Antibody (105011) (抗体用量参考说明书)
3.5 洗涤细胞:用PBS洗涤细胞,去除残留的抗体,并再次用PBS重悬。
3.6 死活染料染色:每孔加入7-AAD (559925),室温避光孵育5min。
3.7 上机检测。
- 完全成熟BMDC检测
4.1 收集细胞:细胞因子干预后,弃培养基上清,用PBS清洗细胞1遍,弃上清,再将贴壁细胞用PBS轻轻吹打重悬。
4.2 计数:用细胞计数仪计数并计算细胞总数,并将按照1e7/mL重悬。
4.3 细胞封闭:100μl/孔加至96孔板或流式管中,并加入Mouse IgG (Mouse FcR Blocking Reagent),4℃孵育30min,300Xg 离心5min,弃上清。
4.4 孵育抗体:各加入以下抗体,4℃孵育30min,300Xg 离心5min,弃上清。
组1:PE anti-mouse CD11c Antibody (117307) (抗体用量参考说明书)
APC anti-mouse CD80 Antibody (104713) (抗体用量参考说明书)
组2:PE anti-mouse CD11c Antibody (117307) (抗体用量参考说明书)
APC anti-mouse CD86 Antibody (105011) (抗体用量参考说明书)
4.5 洗涤细胞:用PBS洗涤细胞,去除残留的抗体,并再次用PBS重悬。
4.6 死活染料染色:每孔加入7-AAD (559925),室温避光孵育5min。
4.7 上机检测。