内皮细胞源干细胞因子调控棕色脂肪细胞脂质积累的机制研究
棕色脂肪组织是哺乳动物体内重要的产热器官,通过非颤抖性产热过程消耗葡萄糖和脂肪酸,对维持能量代谢平衡、抵抗肥胖及相关代谢疾病具有关键作用。
- 最新进展
一、研究背景与科学问题
棕色脂肪组织是哺乳动物体内重要的产热器官,通过非颤抖性产热过程消耗葡萄糖和脂肪酸,对维持能量代谢平衡、抵抗肥胖及相关代谢疾病具有关键作用。棕色脂肪组织具有高度血管化的特征,其功能受到交感神经和局部微环境的精细调控。内皮细胞作为血管壁的主要构成部分,不仅是物质交换的屏障,更被视为重要的旁分泌细胞,通过与脂肪细胞相互作用调节组织功能。干细胞因子及其受体酪氨酸激酶c-Kit在多种生理过程中扮演重要角色,已有研究表明其在代谢组织(如胰腺)的发育和功能维持中不可或缺,并且其表达水平与肥胖状态呈负相关。然而,内皮细胞是否通过分泌SCF与棕色脂肪细胞交流,并具体如何调控后者的脂质代谢与能量稳态,尚不明确。
二、核心发现:内皮细胞-脂肪细胞通过SCF/c-Kit轴进行功能对话
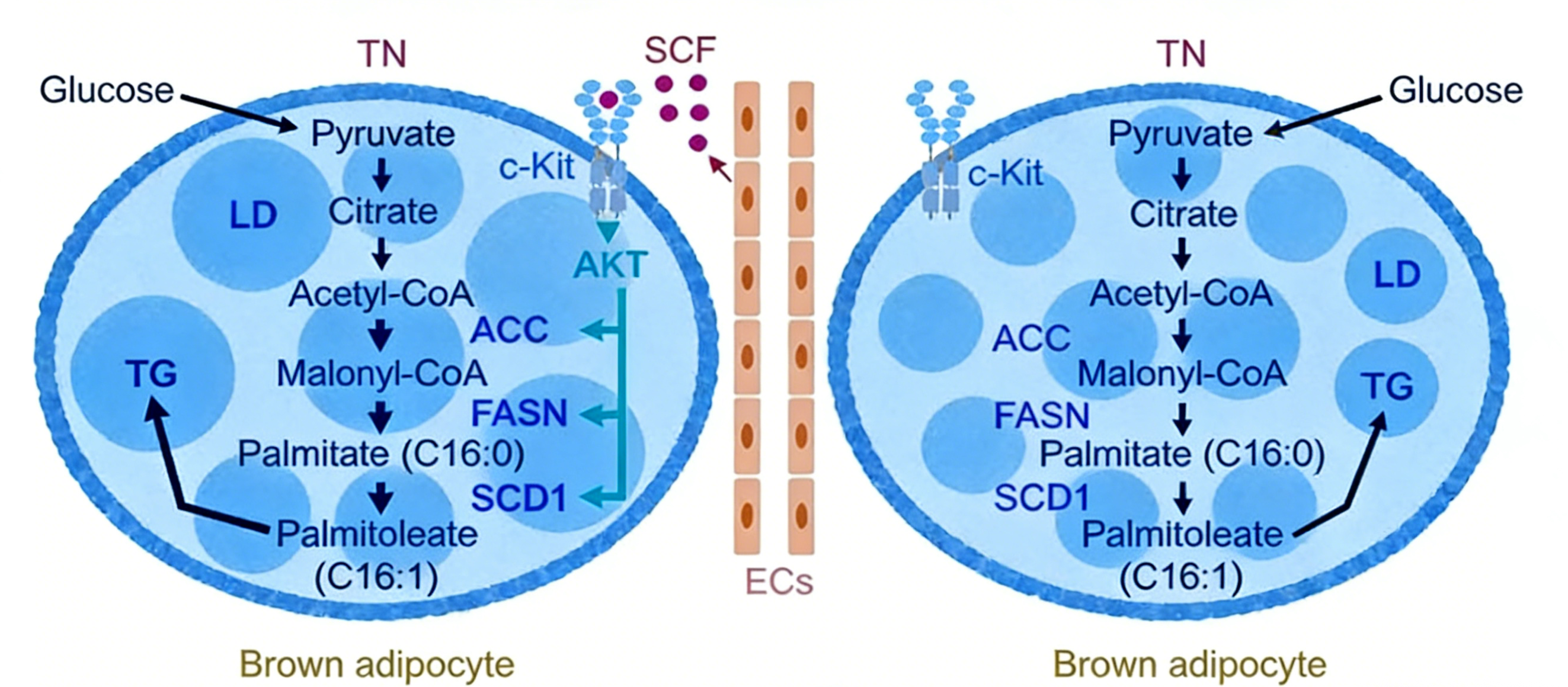
研究团队通过单细胞核RNA测序技术,系统分析了棕色脂肪组织内的细胞异质性,并利用受体-配体互作预测方法,首次揭示了内皮细胞与棕色脂肪细胞之间潜在的SCF/c-Kit信号通路联系。研究发现,c-Kit受体在棕色脂肪细胞中高表达,而其配体SCF不仅由脂肪细胞自身产生,也由内皮细胞显著分泌。这一发现为理解脂肪组织内细胞间通讯提供了新的分子框架。
进一步的实验表明,c-Kit信号通路的状态与棕色脂肪的产热活性密切相关。在冷刺激或β-肾上腺素受体激活(模拟交感神经兴奋)的产热状态下,棕色脂肪组织中c-Kit阳性细胞数量和蛋白表达均显著下降;相反,在去除交感神经支配的模型(模拟产热抑制)中,c-Kit的表达则显著上调,并伴随着脂肪细胞体积增大和脂质合成酶基因表达的增加。这提示c-Kit信号可能负向调控棕色脂肪的产热功能,转而促进脂质的储存。
三、SCF His Tag 蛋白在机制研究中的应用价值
为深入验证内皮细胞来源的SCF对脂肪细胞的具体作用,并获得精确的剂量效应关系,高纯度、生物活性明确的重组蛋白是必不可少的研究工具。SCF His Tag 蛋白 为研究提供了关键支持:
1. 功能验证与机制研究: 该重组蛋白可直接用于体外刺激培养的棕色脂肪细胞系或原代细胞,模拟内皮细胞的旁分泌作用,从而直接观察SCF对脂肪细胞脂质合成、相关基因(如SCD1)表达、以及下游PI3K-AKT信号通路激活的影响。
2. 信号通路解析: 通过应用SCF His Tag 蛋白,并结合c-Kit抑制剂或基因敲低技术,可以明确证实其效应是通过c-Kit受体介导的,并精细解析其下游具体的信号转导级联。
3. 对照与标准化: 在构建内皮细胞条件培养基等功能性实验中,SCF His Tag 蛋白 可作为阳性对照或补充因子,用以确定SCF在复杂分泌组中的贡献比例。
四、分子机制:SCF/c-Kit通过PI3K-AKT通路驱动脂质合成
研究阐明了SCF/c-Kit轴调控脂质代谢的具体分子机制。内皮细胞分泌的SCF与棕色脂肪细胞膜上的c-Kit受体结合后,激活了PI3K-AKT信号通路。活化的AKT进而上调了硬脂酰辅酶A去饱和酶1等关键脂质合成酶的表达和酶活性。这一过程促进了脂肪酸的去饱和反应和甘油三酯的合成,最终导致棕色脂肪细胞内脂滴积累。研究者通过构建内皮细胞特异性SCF敲除小鼠模型,在体验证了这一机制:敲除小鼠棕色脂肪组织中的SCD1蛋白水平及酶活性显著降低,脂肪酸组成发生改变(C16:1/C16:0比例下降),且大型脂质累积的脂肪细胞数量减少。
五、研究意义与未来展望
本研究首次系统揭示了内皮细胞通过分泌SCF,经c-Kit-PI3K-AKT信号轴,促进棕色脂肪细胞脂质合成的全新旁分泌调控机制。这一发现不仅深化了我们对脂肪组织内细胞间通讯网络的理解,也为代谢性疾病的干预提供了新的潜在靶点。抑制SCF/c-Kit信号通路,可能成为减少棕色脂肪组织异常脂质沉积、进而改善全身代谢状态的一种策略。
未来研究可进一步探索:在不同代谢应激条件下(如寒冷、高脂饮食),SCF/c-Kit信号的具体调控网络;除SCD1外,该通路是否还调控其他脂代谢关键酶;以及针对该通路进行干预,是否能在改善代谢的同时,不影响棕色脂肪的基础产热保护功能。SCF His Tag 蛋白 等工具将继续在解答这些后续问题中发挥重要作用。













