基于SCF His Tag蛋白在水凝胶中实现可控固定及其对造血干细胞的功能调控研究
造血干细胞是维持终身造血功能的关键细胞群,其自我更新与分化的命运抉择受到骨髓微环境(niche)中多种细胞因子及细胞外基质的精密调控。
- 最新进展
一、研究背景:生物材料对干细胞微环境的仿生设计
造血干细胞是维持终身造血功能的关键细胞群,其自我更新与分化的命运抉择受到骨髓微环境(niche)中多种细胞因子及细胞外基质的精密调控。为了在体外模拟这一复杂微环境以支持HSC的扩增与表型维持,将关键细胞因子(如干细胞因子)以可控、长效的方式整合至三维生物材料支架中,是组织工程与再生医学领域的重要策略。其中,甲基丙烯酰化明胶水凝胶以其优良的生物相容性、可调机械性能及易于光固化的特性,成为构建体外造血微环境的理想材料。然而,如何将细胞因子高效、稳定地固定于GelMA网络中,并保持其生物活性以精准调控HSC行为,是亟待解决的技术挑战。
二、SCF His Tag 蛋白作为研究工具的优势
在进行细胞因子固定化策略的研究中,高纯度、易于追踪和操作的重组蛋白是基础。SCF His Tag 蛋白 在此类研究中具有独特价值:
1. 高纯度保障: His标签便于通过金属螯合层析进行高效纯化,获得高纯度的SCF蛋白,确保固定化研究的起点明确,减少杂质干扰。
2. 功能验证基础: 可直接用于验证修饰或固定化处理是否影响其与c-Kit受体的结合能力及下游信号激活功能,为后续生物材料的构建提供活性保障。
3. 固定化策略通用性: 其N末端或C末端的His标签为后续可能的定点偶联策略(如通过金属配位或His标签特异性化学反应)提供了额外的化学手柄,增加了固定化方式的灵活性。
三、SCF的化学固定化策略:基于丙烯酰化PEG-NHS的交联方法
为实现SCF在GelMA水凝胶中的长效、可控负载,研究采用了一种两步化学偶联策略:
1. 蛋白功能化: 利用丙烯酰化聚乙二醇活性酯(AC-PEG-NHS)与SCF His Tag 蛋白 表面的伯氨基(赖氨酸残基)在温和条件下(pH 8.0 PBS缓冲液)反应。这一步骤在SCF分子上共价连接了末端带有丙烯酸酯双键的PEG链,得到"双键化"的PEG-SCF偶联物。通过凝胶电泳(如SDS-PAGE)的分子量迁移变化可以验证修饰成功。
2. 水凝胶共价固定: 将修饰后的PEG-SCF偶联物与GelMA预聚液混合,在光引发剂存在下进行紫外光照射。在此过程中,GelMA上的甲基丙烯酸酯双键与PEG-SCF上的丙烯酸酯双键通过自由基共聚反应形成共价网络,从而将SCF永久性地锚定在三维凝胶骨架中。
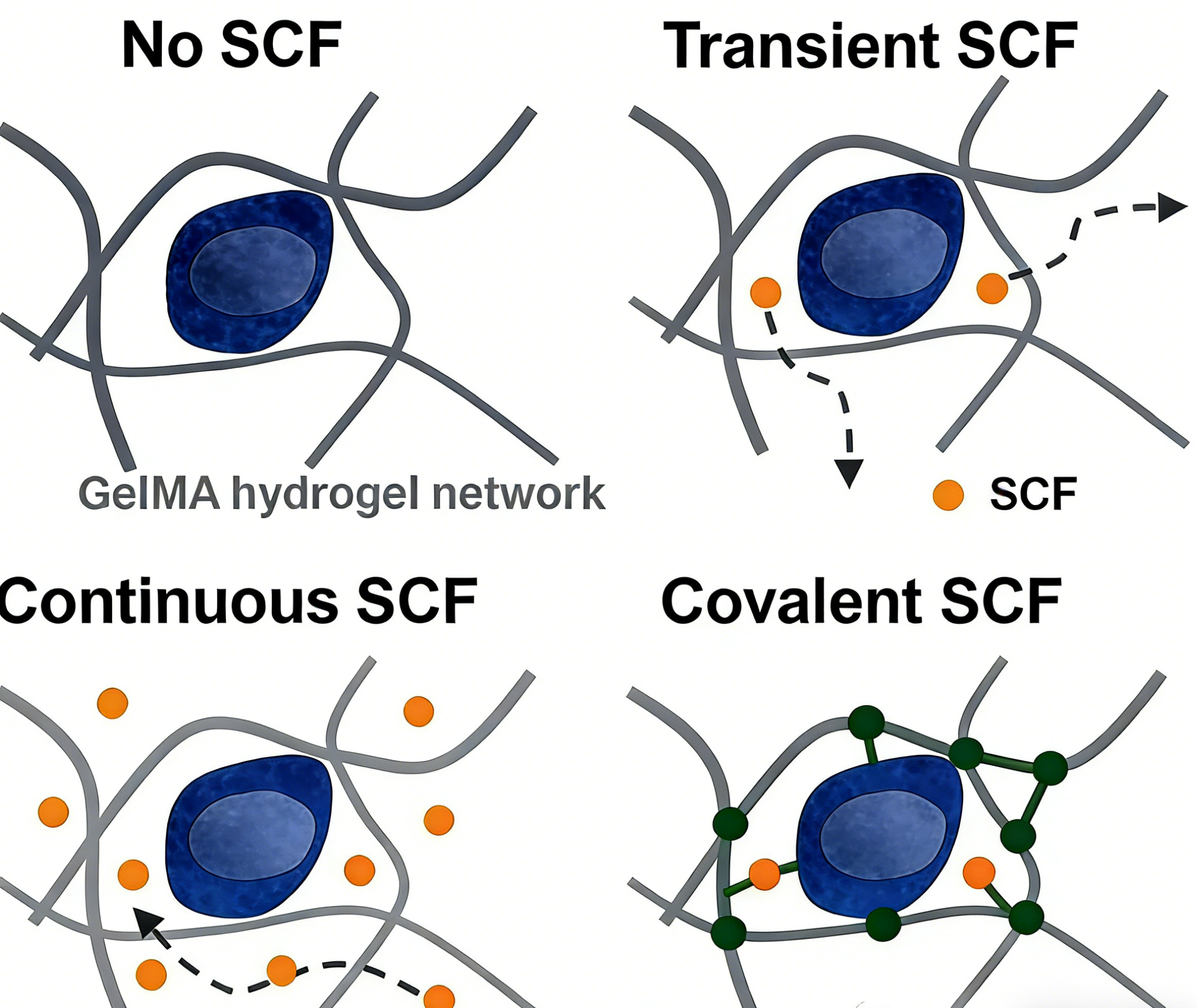
四、不同负载模式对SCF释放动力学及生物活性的影响
为评估化学固定策略的优势,研究系统比较了四种不同的SCF负载模型对HSC功能的影响:
1. 无SCF负载组: 作为阴性对照。
2. 物理混合组: 将SCF His Tag 蛋白 简单混合于GelMA前驱液中,通过物理包埋负载。
3. 持续补充组: 在物理混合的基础上,于培养培养基中持续添加可溶性SCF。
4. 共价固定组: 采用上述AC-PEG-NHS策略将SCF共价固定于GelMA网络中。
研究结果显示:
- 释放动力学: 物理混合的SCF在12小时内快速释放(约60%),而共价固定的SCF在7天内仍能保留超过80%,实现了长效、稳定的局部信号呈递。
- 生物活性保留: 通过细胞增殖实验验证,经AC-PEG-NHS修饰和共价固定后的SCF,其促进HSC增殖的生物活性得到了有效保留。
五、共价固定SCF对造血干细胞功能的选择性调控
在GelMA三维培养体系中,共价固定SCF展现出独特的生物学效应:
1. 增殖与表型调控: 与可溶性SCF持续刺激导致HSC快速扩增不同,在含有共价固定SCF的水凝胶中培养的HSC,其总增殖速度相对较缓。
2. 维持原始性: 更重要的是,共价固定SCF的环境显著提高了维持原始表型(如Lin⁻Sca-1⁺c-Kit⁺表型)的HSC亚群的比例。这表明,由水凝胶基质局部、持续呈递的SCF信号,更有利于模拟体内微环境的生态位功能,促进HSC的自我更新而非快速分化,实现了对HSC命运的选择性调控。
六、总结与展望
本研究通过AC-PEG-NHS交联策略,成功将SCF His Tag 蛋白 长效、活性地共价固定于GelMA水凝胶中,构建了一种能够模拟骨髓生态位关键信号特征的仿生三维微环境。该策略不仅解决了细胞因子在材料中快速流失的问题,更重要的是,揭示了信号呈递方式(可溶性扩散 vs. 基质固定)对HSC命运的深刻影响。这为设计下一代用于造血干细胞体外扩增、维持或分化的智能生物材料提供了重要的设计原则和方法学借鉴。未来,结合其他细胞因子或黏附配体的协同固定,有望构建出功能更加完备、调控更为精细的复合型人工造血微环境。













