α-synuclein:帕金森病的‘捣蛋鬼’大揭秘
α-突触核蛋白(α-synuclein,α-syn)是一种在中枢神经系统突触前及核周表达的可溶性蛋白质,分子量约为14-19 kDa。它在突触活动中发挥着至关重要的作用,并与多种神经退行性疾病,尤其是帕金森病(Parkinson’s Disease,PD)的发病机制和功能障碍密切相关。
- 最新进展
- 产品信息
- 参考文献
α-突触核蛋白(α-synuclein,α-syn)是一种在中枢神经系统突触前及核周表达的可溶性蛋白质,分子量约为14-19 kDa。它在突触活动中发挥着至关重要的作用,并与多种神经退行性疾病,尤其是帕金森病(Parkinson’s Disease,PD)的发病机制和功能障碍密切相关。
帕金森病是全球第二大常见的神经退行性疾病,主要影响运动功能,表现为震颤、僵硬和运动迟缓等症状。尽管现有药物治疗可以缓解部分症状,但尚无法阻止疾病的进展。α-突触核蛋白作为帕金森病的重要病理特征之一,深入研究其在PD中的作用,不仅为疾病的治疗提供了潜在靶点,也为早期诊断开辟了新的方向。
一、α-syn的生物学特性与功能
(一)基本特性
α-syn是一种由140个氨基酸组成的小分子蛋白,主要在中枢神经系统的神经元中表达,尤其集中于突触前末梢。其基因编码由SNCA基因负责,位于人类4号染色体。在正常生理条件下,α-syn参与调节突触可塑性、神经递质释放与转运,并可能对线粒体功能和钙离子平衡起到关键作用。
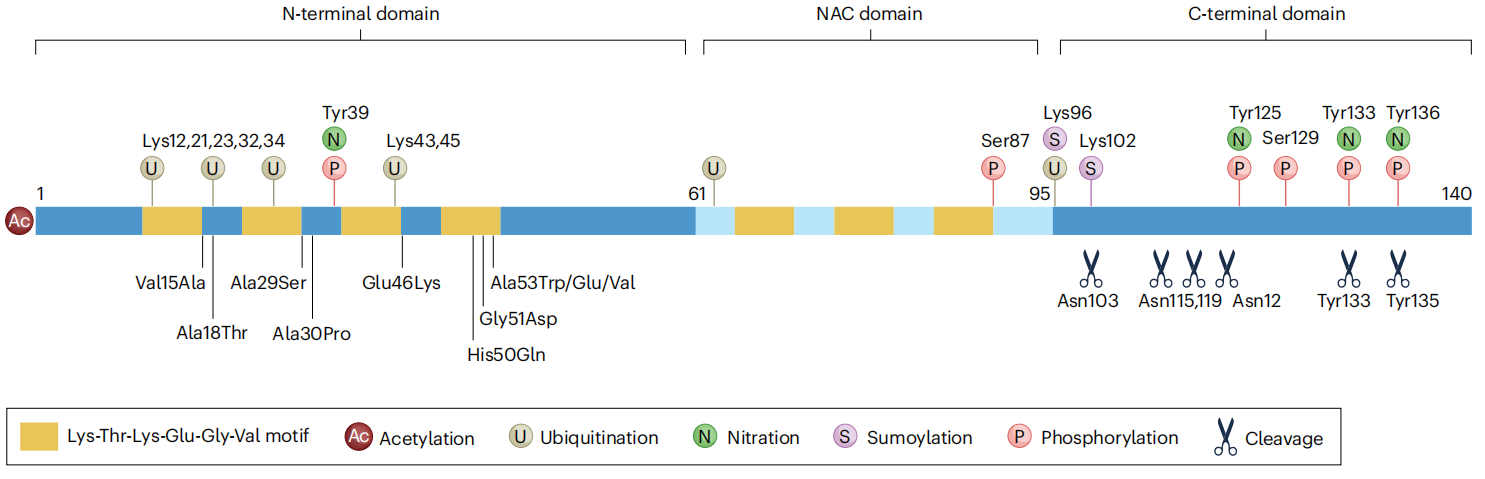
具有与帕金森病相关的改变的α-突触核蛋白的结构。该示意图显示了α-突触核蛋白的一级结构以及点突变、翻译后修饰和截断的位点,这些位点与α-突触核蛋白病理有关。
(二)生理功能
突触功能调节:α-syn作为单体参与突触小泡胞吐作用,调节突触小泡运输和随后的神经递质释放。它通过与多巴胺转运蛋白(DAT1)结合,调节多巴胺神经传递,从而在维持神经元稳态和突触传递中发挥关键作用。
分子伴侣作用:在多聚体膜结合状态下,α-syn与半胱氨酸串蛋白-α/DNAJC5一起帮助突触前质膜上的SNARE(可溶性NSF附着蛋白受体)折叠,维持突触结构的稳定性。
神经保护作用:α-syn能够减少神经元对各种凋亡刺激的响应,降低caspase-3的激活,从而发挥神经保护作用。
二、α-syn在神经退行性疾病中的作用
(一)帕金森病
α-syn是帕金森病中路易小体的主要结构成分,其基因突变与家族性帕金森病密切相关。在帕金森病患者的脑内,α-syn会发生异常折叠,形成不溶性的纤维状聚集物,这些聚集物被称为路易小体(Lewy bodies)和路易神经丝(Lewy neurites),是疾病的显著病理标志。异常折叠的α-syn不仅是简单的“垃圾堆积”,其中间寡聚体形式具有高度毒性。这些寡聚体能够与细胞膜相互作用,破坏膜的完整性,引发神经元内的钙稳态紊乱。此外,α-syn的异常聚集会干扰线粒体的正常功能,削弱神经元的能量供给,氧化应激的累积进一步加剧了这一过程,形成一种恶性循环。这种细胞内环境的改变最终导致了多巴胺能神经元的退化,而多巴胺的缺失是帕金森病运动症状的直接原因。
(二)其他神经退行性疾病
除了帕金森病,α-syn的异常聚集和过度表达也与其他神经退行性疾病相关,如阿尔茨海默病、路易体痴呆(dementia with Lewy bodies,DLB)以及多系统萎缩(multiple system atrophy,MSA)等。在阿尔茨海默病患者的脑组织中,也可能观察到α-syn的过度积累。在DLB患者中,路易小体的病理标志主要是α-syn异常聚集成低聚体和原纤维,主要存在于神经元细胞。随着疾病的进展,路易小体遍布脑干,弥漫分布于大脑皮层,并深入边缘系统(海马和杏仁核等)、黑质或脑干其他核团。MSA的主要特征是在少突胶质细胞胞浆内出现以α-syn为主要成分的包涵体。
三、针对α-syn的治疗策略
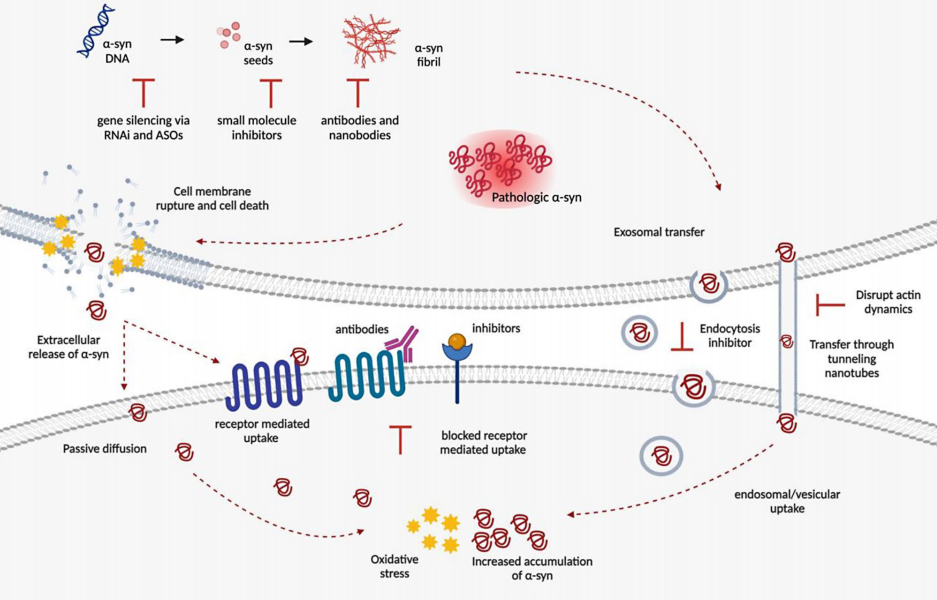
(一)基因治疗
通过基因编辑技术(如CRISPR/Cas9)或基因沉默策略,减少α-syn的表达,可能是未来治疗帕金森病等神经退行性疾病的新途径。
(二)小分子抑制剂
研究人员正在寻找能够抑制α-syn聚集和毒性的小分子化合物,以期作为潜在的治疗药物。
(三)抗体治疗
针对α-syn的人源化单克隆抗体(如PRX002)目前正处于临床试验阶段,旨在通过减少α-syn的聚集和毒性作用,改善帕金森病患者的症状。
(四)增强细胞自噬和溶酶体功能
增强细胞自噬和溶酶体功能的策略也正在探索中,以期通过清除异常蛋白来减缓疾病进展。
四、α-syn作为诊断靶点的潜力
α-syn的异常聚集贯穿PD的病理过程,其分布不仅限于中枢神经系统的神经细胞内,还存在于脑脊液(CSF)、血液、唾液等体液,以及皮肤、肠道、唾液腺等外周组织中,这种广泛分布使其成为PD早期诊断的潜在生物标志物。研究表明,PD患者CSF中α-syn寡聚体和磷酸化形式显著升高,总α-syn水平下降,为PD诊断提供了高敏感性的标志物。但是CSF采样的侵入性限制了其广泛应用。血浆和血清的非侵入性采样更易于被接受,但检测结果受样本处理、检测方法的影响较大,检测结果存在争议。外泌体α-syn的检测被认为是一种较为可靠的替代方案,其检测灵敏性和特异性接近于CSF,但是仍需进一步验证其在临床诊断中的稳定性,并优化检测技术。唾液检测作为一种非侵入性方法,也被视为PD诊断的潜在工具。然而,现有研究中唾液α-syn水平的变化结果不一致,需要统一采样和分析标准,以提高结果的可重复性和准确性。
在分子影像技术中,正电子发射断层扫描(PET)和单光子发射计算机断层扫描(SPECT)可实现活体中α-syn病理沉积的可视化,提供早期诊断和疾病进展监测的工具。这类技术通过影像探针靶向结合α-syn聚集体,生成高对比度图像,实时追踪神经元内的病理变化。现有探针如[11C]-PIB、18F-BF227和SIL26等在结合α-syn聚集体方面取得了一定进展,但[11C]-PIB和18F-BF227未能在路易小体内显示良好的结合效果,SIL26在跨血脑屏障方面仍需优化。因此,开发具有更高亲和力、更好成像特异性的分子影像探针,将有助于实现PD的早期诊断、进展评估及疗效监测。
五、结论
α-突触核蛋白在神经退行性疾病的发病机制中扮演着核心角色,尤其是在帕金森病中。深入研究α-syn的生物学特性、功能及其在疾病中的作用机制,不仅有助于理解这些疾病的发病过程,还为开发新的治疗策略和诊断方法提供了重要线索。随着研究的不断深入,相信未来将有更多针对α-syn的有效治疗策略出现,为神经退行性疾病患者带来希望。同时,跨学科的合作与创新也将进一步推动这一领域的发展。
相关产品:
α-synuclein His tag Protein, Human
货号: UA011215
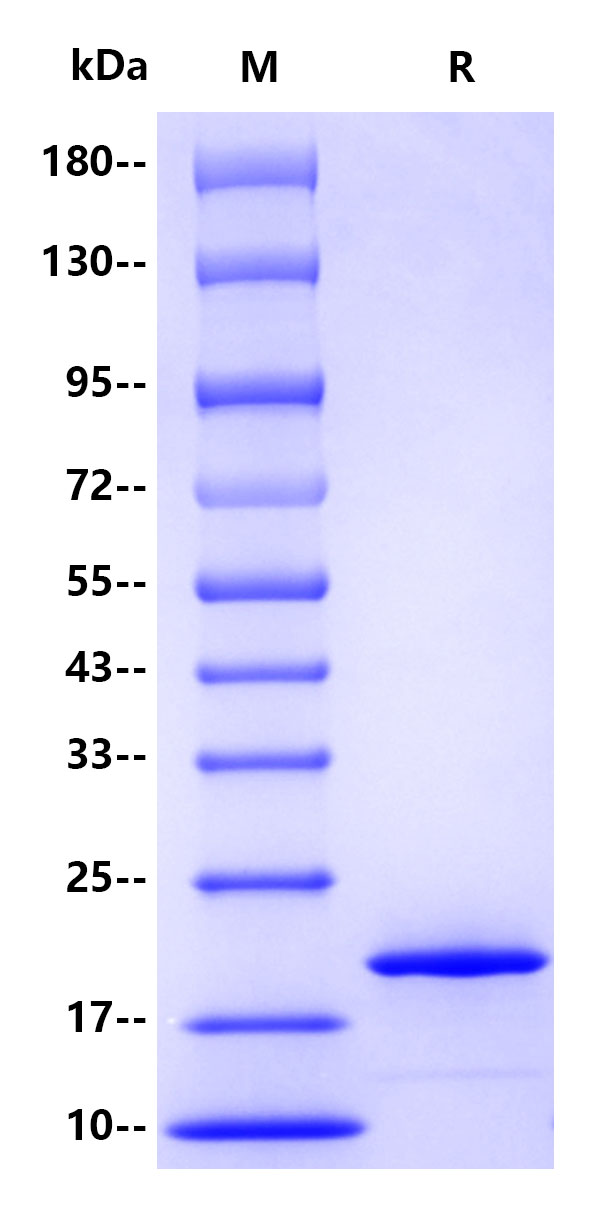
>95% by SDS-PAGE
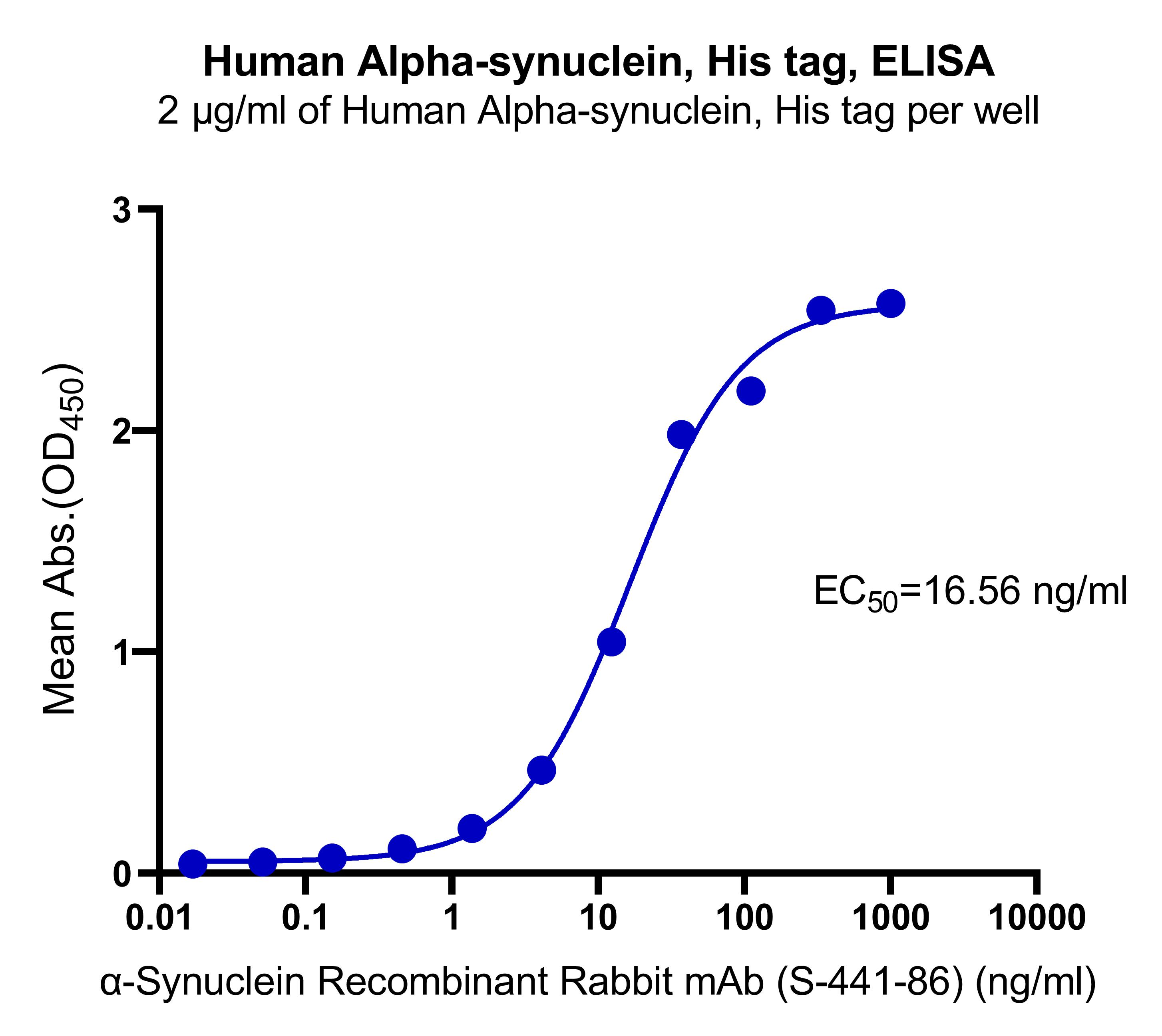
Immobilized α-synuclein His tag Protein, Human at 2 μg/mL (50 μL/well) can bind α-Synuclein Recombinant Rabbit mAb (S-441-86) (S0B0344) with EC50 of 13.11-21.33 ng/ml.
点击下方的产品货号,直达官网详情页供您了解
Mark Cookson.α-Synuclein and neuronal cell death.Molecular Neurodegeneration,(2009).
Hye-Jin Park; Tae‐In Kam; Valina L. Dawson; Ted M. Dawson.α-Synuclein pathology as a target in neurodegenerative diseases.Nature Reviews Neurology,(2024).
Grace m. Kuo; Ramhari Kumbhar; W. Frank Blair; Valina L. Dawson; Valina L. Dawson; et al. Emerging targets of α-synuclein spreading in α-synucleinopathies: a review of mechanistic pathways and interventions.Molecular Neurodegeneration,(2025).













