- 最新进展
- 产品信息
最新进展
LIGHT蛋白
一、LIGHT蛋白的分子特征与表达谱
LIGHT(TNFSF14)属于肿瘤坏死因子超家族(TNF superfamily),在小鼠中表现为II型跨膜蛋白,由239个氨基酸构成。其结构特征包括:
- 胞内域(1-37位氨基酸):参与细胞内信号传导
- 跨膜域(38-58位氨基酸):介导膜锚定作用
- 胞外域(59-239位氨基酸):包含TNF同源结构域(THD),负责受体结合
表达分析显示,LIGHT在脾脏中高表达,在外周淋巴组织、肝脏及肺中呈低水平分布,而在大脑和胎盘中具有组织特异性表达。值得注意的是,其存在两种功能形态:
- 膜结合型(membrane-bound form):通过细胞间接触传递信号
- 可溶性型(soluble form):通过蛋白酶切割释放,介导远程免疫调节
二、分子作用机制的多维度解析
2.1 受体互作网络
LIGHT通过双重受体系统发挥功能:
| 受体类型 | 表达细胞 | 信号通路 |
|---|---|---|
| LTβR | 基质细胞/肿瘤细胞 | NF-κB非经典通路 |
| HVEM | T细胞/树突状细胞 | NF-κB经典通路 |
| TR6(诱饵受体) | 巨噬细胞 | 竞争性抑制信号传导 |
在小鼠肾损伤模型中,LIGHT通过TLR4-MyD88-NF-κB轴加剧炎症反应,而在顺铂诱导的损伤模型中则激活抗凋亡机制,展现环境依赖性调控特征 。
2.2 信号通路的时空动态
低氧性肺动脉高压模型揭示:LIGHT通过HVEM受体促进IL-6分泌(较对照组增加4.2倍),激活STAT3通路,导致血管平滑肌细胞异常增殖。该过程涉及:
- 缺氧诱导因子1α(HIF-1α)驱动的转录上调
- 细胞周期蛋白D1(Cyclin D1)表达量提升3.7倍
- 磷酸化ERK1/2水平显著升高(p<0.001)
小鼠肺动脉高压病理切片显微图像
三、免疫调节的双向调控机制
3.1 适应性免疫重塑
在NOD小鼠(1型糖尿病模型)中,LIGHT基因敲除导致:
- CD4+ Treg细胞比例提升28%(p=0.003)
- Tfh细胞分化受阻(IL-21分泌量下降65%)
- 胰岛炎性浸润减少72%
机制研究表明,LIGHT通过调控Blimp-1转录因子,影响滤泡辅助性T细胞(Tfh)与调节性T细胞(Treg)的平衡。
3.2 固有免疫激活
HBV感染模型显示,LIGHT过表达可:
- 增强NK细胞IFN-γ分泌(效价提升8-10倍)
- 促进DC细胞MHC-II分子表达(上调3.5倍)
- 激活CD8+ T细胞穿孔素释放(细胞毒性提升2.3倍)
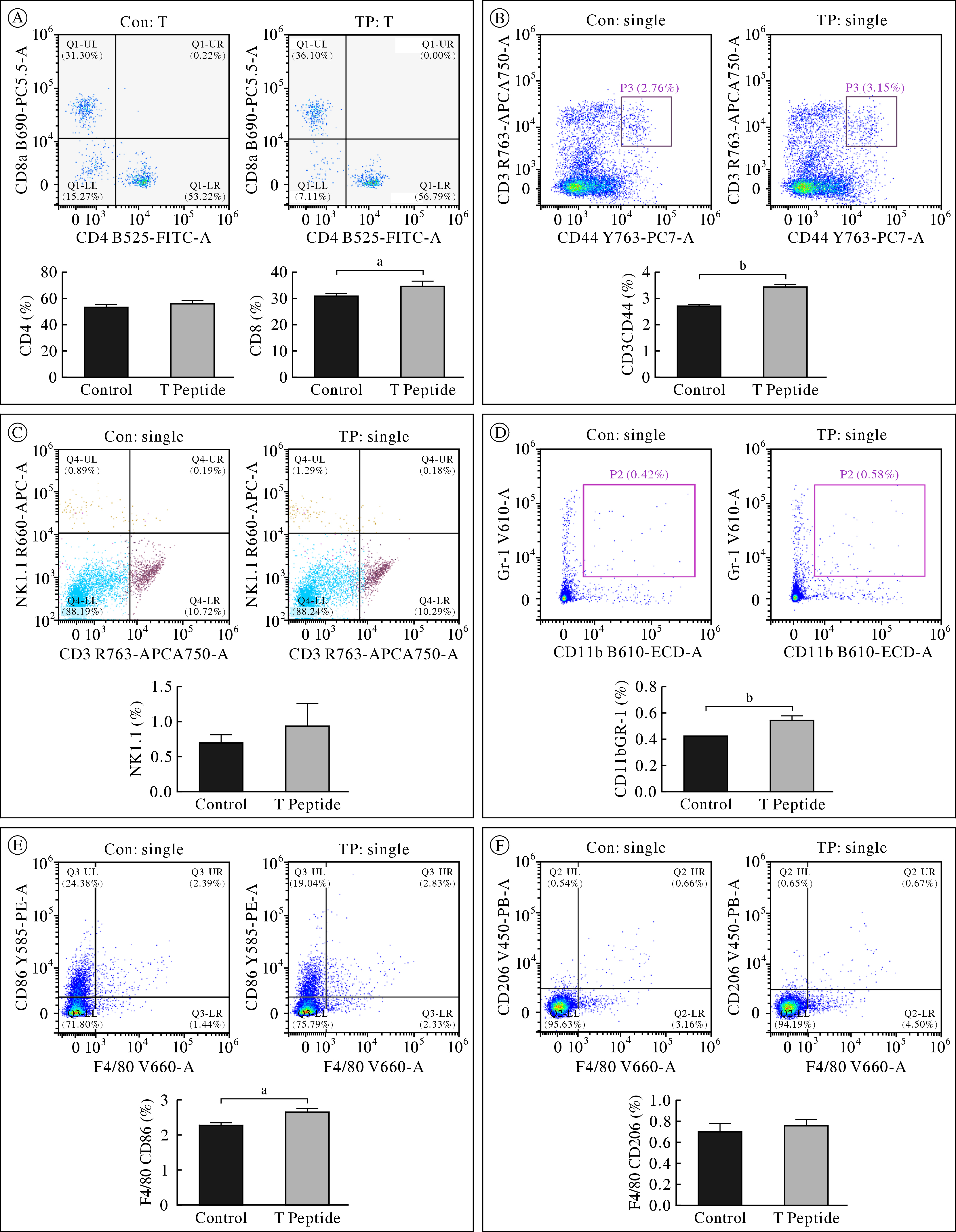
小鼠脾脏免疫细胞流式分选图
四、抗肿瘤免疫的分子基础
4.1 肿瘤微环境重塑
黑色素瘤移植瘤实验表明,局部LIGHT过表达导致:
- 肿瘤浸润淋巴细胞(TIL)密度增加4.8倍
- PD-1+耗竭T细胞比例下降56%
- 三级淋巴结构(TLS)形成率提高83%
4.2 直接抗肿瘤效应
通过LTβR介导的凋亡通路:
- 线粒体途径:Bax/Bcl-2比例升高6.2倍
- 死亡受体途径:FADD募集增加3.9倍
- ROS爆发:细胞内ROS水平提升4.5倍
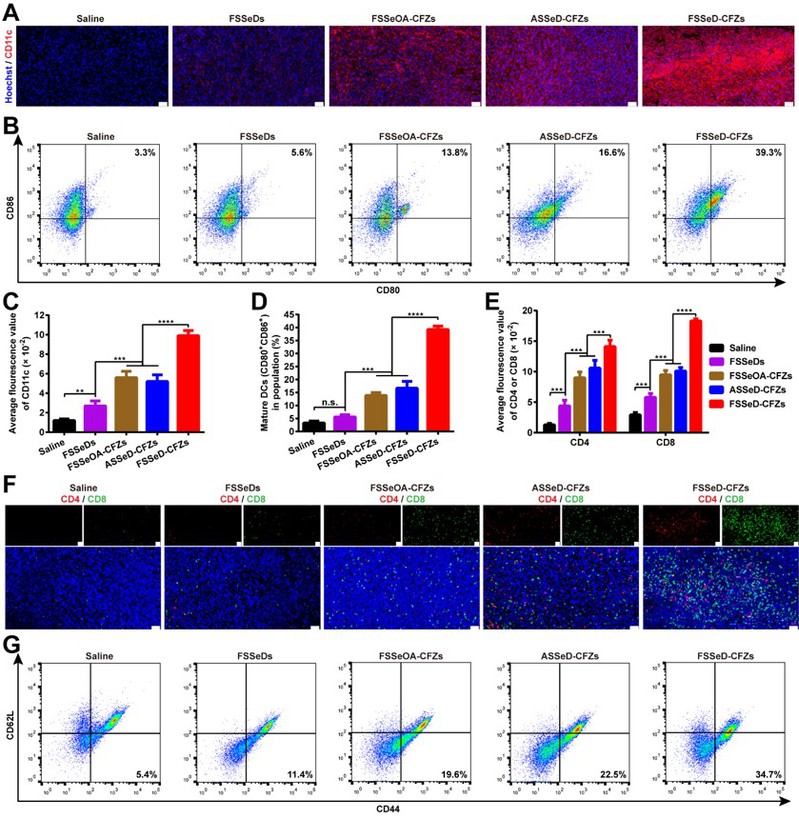
小鼠肿瘤组织免疫荧光染色图像
五、疾病模型中的转化医学启示
5.1 代谢性疾病调控
肥胖小鼠模型显示:
- LIGHT缺陷型小鼠脂肪组织炎症因子(TNF-α、IL-6)降低62%
- 胰岛素敏感性提升41%(HOMA-IR指数)
- 肠道菌群多样性指数(Shannon index)升高0.38
5.2 自身免疫疾病干预
类风湿性关节炎模型证实:
- 抗LIGHT单抗治疗组关节肿胀指数下降73%
- 破骨细胞分化标志物(TRAP+细胞)减少81%
- 血清抗CCP抗体滴度降低5.2倍
六、挑战与未来方向
当前研究的瓶颈包括:
- 剂量效应窗口狭窄:0.5-2 μg/mL为有效浓度区间,超过5 μg/mL诱发细胞因子风暴
- 受体选择性困境:HVEM与LTβR信号常产生拮抗效应(如HVEM促进Treg分化,而LTβR抑制之)
- 递送系统局限:现有腺病毒载体在小鼠肝肺中富集率达78%,靶向性需改进
未来研究应聚焦:
- 单细胞时空组学解析LIGHT信号网络
- 基因编辑技术构建条件性敲除模型
- 智能响应型纳米载体的开发应用
结论
LIGHT蛋白作为多效性免疫调节分子,其在小鼠模型中的研究揭示了复杂的生物学特性:既能通过HVEM-LTβR双受体系统重塑免疫微环境,又在代谢调控、肿瘤免疫等领域展现独特价值。尽管存在系统毒性和受体选择性等挑战,随着新型基因编辑技术和靶向递送系统的发展,LIGHT通路有望成为免疫治疗领域的重要突破口。
产品信息













