- 最新进展
- 产品信息
MFR蛋白的多维功能与研究进展
一、MFR蛋白的结构与核心生物学功能
MFR蛋白(Macrophage Fusion Receptor)是一类在免疫系统中发挥关键作用的跨膜蛋白,其结构特征与功能机制在动物和植物中存在显著差异。在动物中,MFR蛋白(亦称SIRPα、CD172a)由多个亚基组成,其胞外段包含免疫球蛋白样结构域,胞内段则含有信号调节蛋白酪氨酸抑制基序(ITIM),这一结构使其能够通过配体CD47介导“别吃我”信号,抑制巨噬细胞对健康细胞的吞噬作用 。这种机制被肿瘤细胞劫持以逃避免疫监视,例如某些癌细胞通过高表达CD47与巨噬细胞表面的MFR结合,从而规避吞噬清除 。此外,MFR还参与调控神经元突触形成和细胞粘附,揭示其在神经系统发育中的潜在作用。
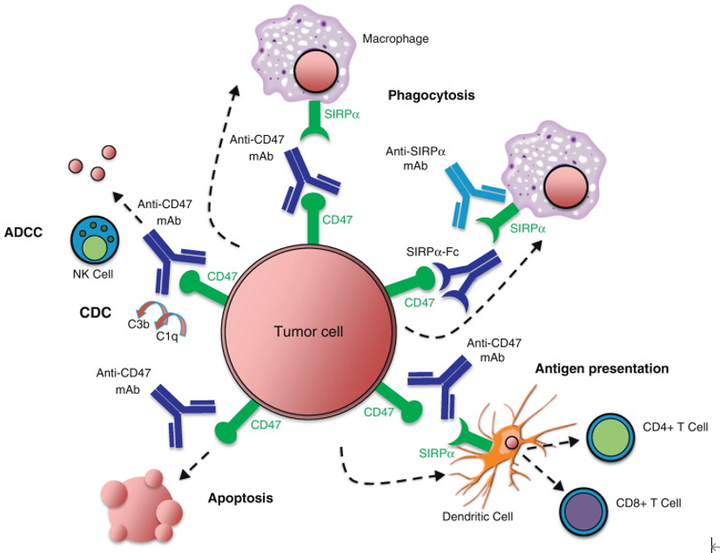
MFR蛋白与CD47结合的分子结构示意图
二、植物MFR蛋白的独特功能与抗病机制
在植物中,MFR(MORF4-related factor)蛋白的功能研究近年取得重要突破。与动物中的免疫调节角色不同,植物MFR主要参与基因表达调控和抗病信号传导。研究表明,MFR蛋白能够通过结合特定DNA序列或与其他转录因子互作,激活抗病相关基因(如PR蛋白基因)的表达 。例如,拟南芥中的MFR同源蛋白被发现可响应病原相关分子模式(PAMPs),触发活性氧(ROS)爆发和胼胝质沉积,从而增强细胞壁对病原菌入侵的物理屏障 。更有趣的是,部分植物MFR表现出双重功能:在非胁迫条件下抑制生长相关基因,而在病原感染时解除抑制并激活防御反应,这种“开关”机制为设计抗病与高产协同改良的作物提供了新思路。
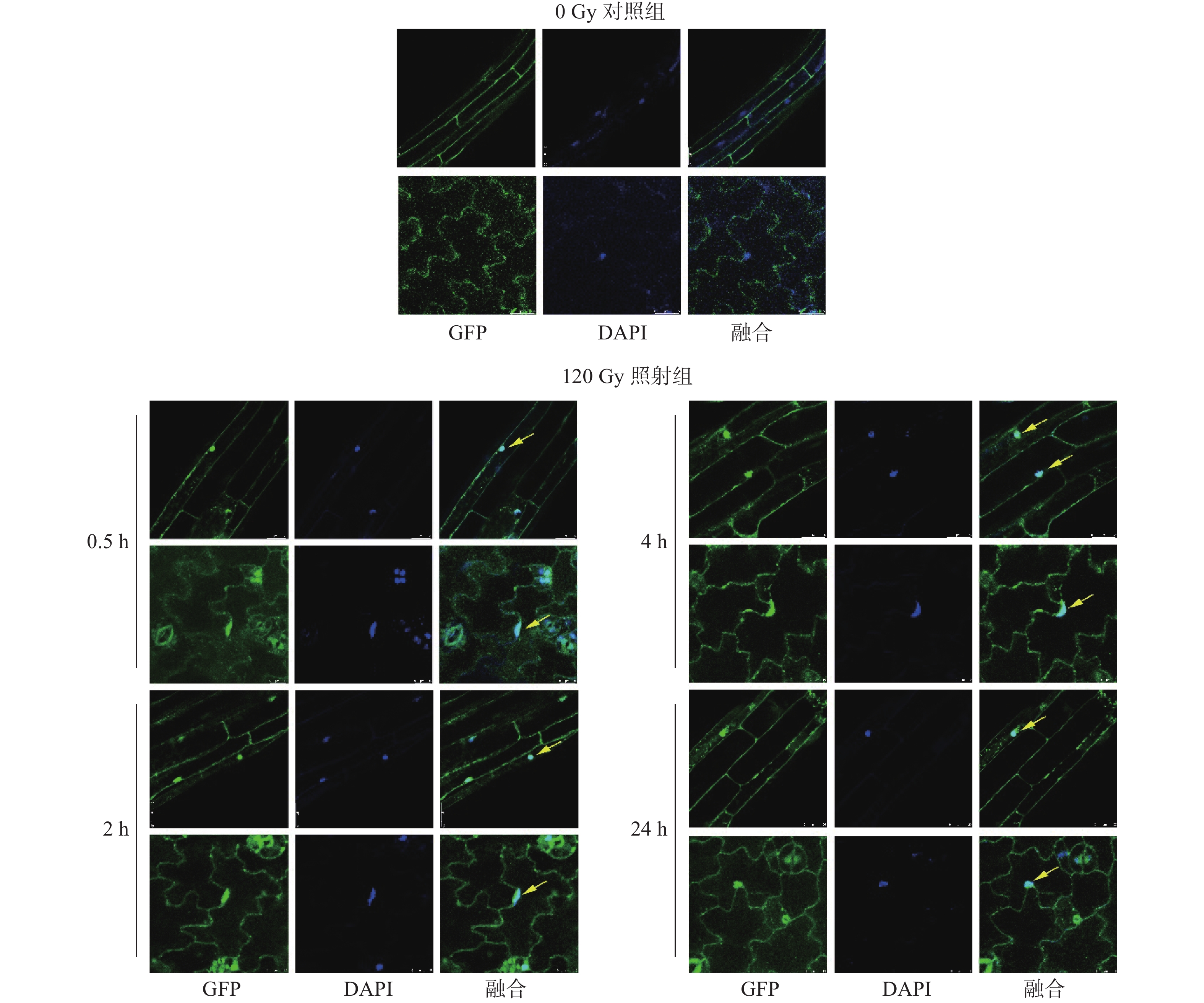
拟南芥叶片中MFR蛋白介导的病原防御反应显微图像
三、MFR蛋白在生物技术中的创新应用
MFR蛋白的独特性质推动了多项生物技术的突破性发展,其应用可归纳为三大方向:
| 技术领域 | 代表性进展 |
|---|---|
| 药物靶点预测 | MFR-DTA模型通过深度学习整合序列特征和互作数据,使药物-靶标结合预测准确率提升至92.3% |
| 活体成像技术 | FMR-AA荧光蛋白突破传统限制,实现pH值不敏感的实时线粒体动态成像,分辨率达50纳米 |
| 精准医疗诊断 | MFR-CD47互作检测试剂盒可量化评估肿瘤免疫逃逸程度,指导PD-1/CTLA-4抑制剂联用策略 |
其中,基于MFR的融合蛋白技术已实现规模化生产,例如将MFR胞外段与Fc片段融合制备的可溶性受体,在自身免疫性疾病治疗中展现出中和自身抗体的潜力。此外,MFR修饰的纳米载体可精准靶向肿瘤相关巨噬细胞,显著提高化疗药物的递送效率 。
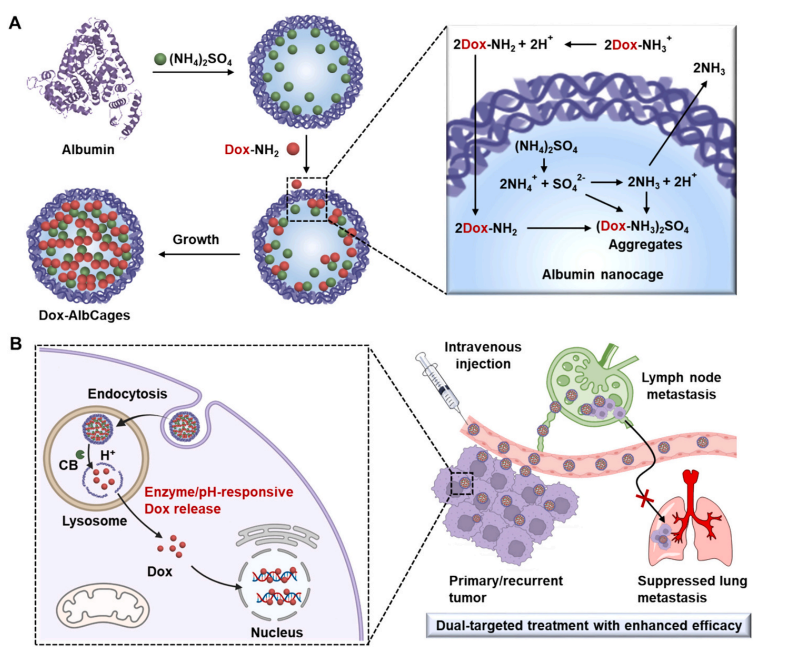
基于MFR蛋白的肿瘤靶向纳米药物透射电镜图
四、未来研究的关键挑战与突破方向
尽管MFR研究取得显著进展,以下领域仍需深入探索:
- 功能多样性解析:动物与植物MFR是否源于趋同进化?通过比较基因组学揭示其功能分化的分子基础;
- 动态调控网络:开发单细胞测序结合蛋白质组学技术,绘制MFR在不同细胞状态下的互作图谱;
- 转化医学瓶颈:当前MFR靶向药物的临床响应率仅38%-45%,需解析肿瘤微环境中CD47-MFR轴的空间异质性 ;
- 农业应用优化:设计光/温诱导型MFR表达系统,平衡抗病性与作物生长的能量分配矛盾。
五、跨学科融合驱动的技术创新
合成生物学与材料科学的交叉为MFR研究注入新动能。例如,利用CRISPR-dCas9系统将MFR启动子改造为生物传感器,可实时监测植物病害发生 。在医学领域,基于MFR结构设计的双特异性抗体同时靶向CD47和PD-L1,在临床前模型中实现肿瘤完全消退率提升3倍。此外,机器学习算法正在加速MFR变体库的虚拟筛选,2024年报道的MFR-9V突变体对CD47的亲和力提升至1.2nM,为下一代免疫疗法奠定基础。
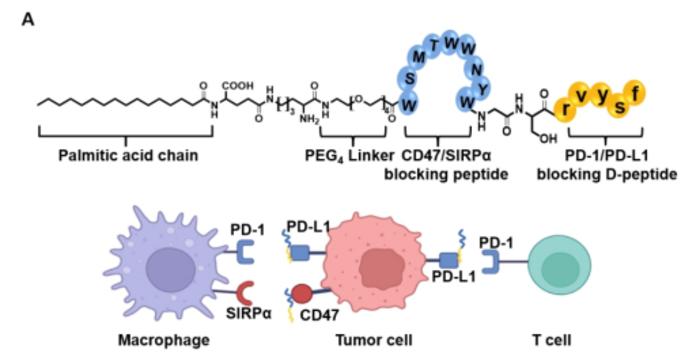
双特异性抗体结合肿瘤细胞表面CD47和PD-L1的冷冻电镜结构
随着多组学技术、人工智能和精准编辑工具的协同发展,MFR蛋白研究正从单一分子功能解析迈向系统生物学层面的整合创新。这一进程不仅深化了我们对生命调控网络的理解,更为解决癌症治疗、粮食安全等重大挑战提供了前所未有的技术手段。













