- 最新进展
- 产品信息
最新进展
ASGPR:肝脏的“糖蛋白捕手”与小核酸药物递送的关键
在人体的肝脏中,存在着一种神奇的受体,它像一位精准的“糖蛋白捕手”,专门识别和捕捉特定的糖蛋白。这个受体就是去唾液酸糖蛋白受体(ASGPR)。近年来,ASGPR在医学领域尤其是小核酸药物递送中扮演了极为重要的角色,成为了科研人员关注的焦点。
ASGPR的发现与结构
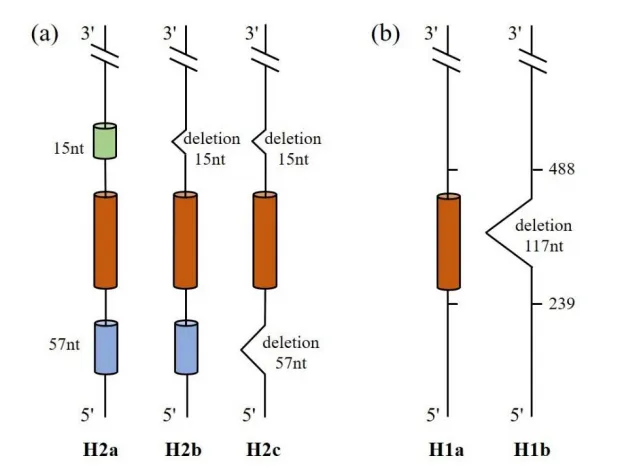
ASGPR的故事可以追溯到1965年,当时美国科学家Gilbert Ashwell和Anatol Morell在研究中发现了这种特殊的受体,因此它也被称作“Ashwell-Morell受体”。ASGPR由两个不同基因编码的亚基组成:大亚基H1(分子量约48 kDa)和小亚基H2(分子量约40 kDa)。这两个亚基在结构上高度同源,都属于Ⅱ型跨膜蛋白。在哺乳动物中,这两种亚基的比例约为3:1,它们共同协作,发挥着内吞作用。
ASGPR的表达具有极强的极性,主要集中在肝实质细胞的正弦和基底外侧细胞膜表面。除了肝脏,ASGPR也在一些肝外组织中有表达,如腹膜巨噬细胞、睾丸、精子、肠上皮细胞和甲状腺细胞等。然而,肝脏中ASGPR的表达量远超其他部位,一个肝细胞表面平均高表达约50万个ASGPR。这种高表达使得ASGPR在肝脏中具有极高的识别和结合能力。
ASGPR的“捕食”机制
ASGPR的“捕食”对象是末端带有半乳糖(Gal)残基或乙酰半乳糖胺(GalNAc)残基的寡糖或寡糖蛋白。它能够精准地识别这些糖基结构,并通过内吞作用将其吞噬。ASGPR的配体种类丰富,包括去唾液糖蛋白、乳糖酸、半乳糖化配体、无唾液酸胎球蛋白以及豆甾醇糖苷等。其中,GalNAc是与ASGPR结合能力最强的一种乳糖类似物,这种特性为药物递送提供了重要的契机。
ASGPR与小核酸药物递送
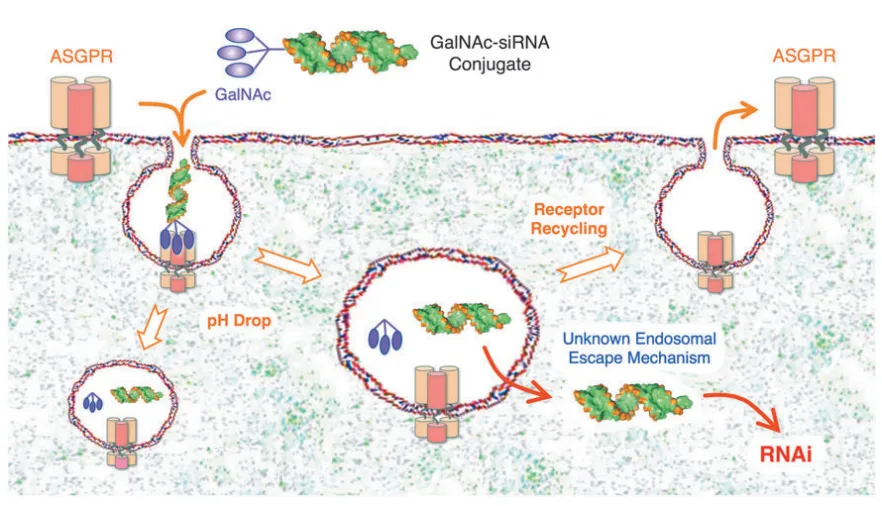
在小核酸药物领域,ASGPR成为了实现肝靶向递送的关键靶点。小核酸药物如siRNA具有基因沉默效率高、特异性好、靶点范围广等优点,但它们通常不具备组织靶向性,且难以自由通过生物膜。GalNAc(N-乙酰半乳糖胺)作为一种高效的ASGPR靶向配体,被广泛应用于siRNA药物的递送系统。
GalNAc修饰的siRNA药物能够通过ASGPR介导的内吞作用进入肝细胞。具体过程如下:GalNAc与肝细胞表面的ASGPR结合,随后通过网格蛋白介导的内吞作用,将siRNA从细胞表面转运至细胞质内部。在细胞内,GalNAc-siRNA偶联物与ASGPR分离,释放出的游离siRNA在细胞质中沉默目标基因,从而发挥药效。
目前,上市的siRNA药物绝大多数采用GalNAc修饰来完成细胞内递送。这种递送系统不仅提高了siRNA的递送效率,还显著增强了其肝细胞靶向性,减少了药物在非靶组织中的分布,降低了潜在的副作用。
ASGPR检测的重要性
在小核酸药物研发初期,检测肝细胞膜表面ASGPR的表达情况具有重要意义。ASGPR的表达水平直接影响siRNA等小核酸药物的摄取和转染效率。通过检测ASGPR的表达,科研人员可以优化药物设计,提高药物的递送效果。此外,ASGPR的检测还可以用于评估药物的靶向性,为临床前研究提供重要的数据支持。
未来展望
ASGPR在小核酸药物递送中的应用前景广阔。随着对ASGPR结构和功能的深入研究,科学家们有望开发出更高效、更精准的药物递送系统。例如,通过设计新型的GalNAc类似物或优化偶联策略,可以进一步提高药物的递送效率和靶向性。此外,ASGPR在其他疾病中的潜在应用也值得探索,如利用其内吞机制递送基因治疗药物或蛋白质药物。
总之,ASGPR作为肝脏的“糖蛋白捕手”,不仅在生理过程中发挥着重要作用,还在小核酸药物递送中扮演了关键角色。它的发现和应用为现代医学带来了新的希望,未来有望为更多患者带来福音。
产品信息













