H-2Kb MHC四聚体揭示免疫途径对mRNA疫苗诱导肺驻留记忆T细胞分化的调控机制
mRNA疫苗接种技术展现出多重免疫学优势:其免疫原性可同时激活CD8+ T细胞、CD4+ T细胞并诱导抗体产生,形成适应性免疫应答网络;该平台不依赖病毒载体递送系统,有效规避了载体预存免疫对加强免疫的潜在限制;工业化生产流程的模块化设计更赋予其快速规模化制备能力。
- 最新进展
- 产品信息
Route of self-amplifying mRNA vaccination modulates the establishment of pulmonary resident memory CD8 and CD4 T cells
mRNA疫苗接种技术展现出多重免疫学优势:其免疫原性可同时激活CD8+ T细胞、CD4+ T细胞并诱导抗体产生,形成适应性免疫应答网络;该平台不依赖病毒载体递送系统,有效规避了载体预存免疫对加强免疫的潜在限制;工业化生产流程的模块化设计更赋予其快速规模化制备能力。标准免疫程序采用21天(BNT162b2)或28天(mRNA-1273)间隔的两次肌肉注射(IM)方案,并在初始免疫后5个月通过追加剂次实现免疫记忆强化。当前该技术平台正拓展至通用流感疫苗开发及肿瘤免疫治疗领域,这类应用场景高度依赖组织驻留型细胞免疫应答,迫切需要解析mRNA疫苗诱导的记忆性CD8+ T细胞与CD4+ T细胞的分化轨迹及组织分布特征。
传统疫苗技术虽成功控制乃至消灭多种传染病,但对HIV、疟原虫、结核分枝杆菌及流感病毒等持续性病原体的防控仍存显著局限,凸显新型疫苗设计范式的必要性。面对SARS-CoV-2的全球大流行威胁,mRNA疫苗技术凭借其研发周期短、免疫应答广谱的优势迅速完成临床转化,实践证明其可有效预防重症疾病发生。
相较于巡逻于血液及淋巴系统的循环记忆T细胞(Tcm),组织驻留记忆T细胞(Trm)作为非淋巴组织免疫监测的关键效应群体,在局部感染时通过快速启动病原体清除机制发挥核心保护作用。激活状态的CD8+ Trm兼具即时细胞毒活性与天然免疫样"即时效应功能与免疫监测功能",可构建抗病毒组织屏障,其效应功能进一步受CD4+ Th1型Trm分泌的IFN-γ协同增强。值得注意的是,肺部驻留CD4+ T滤泡辅助细胞(Tfh)在异源流感病毒再感染时,可促进呼吸道黏膜抗体亲和力成熟。肺门淋巴结中检测到的Trm群体提示,区域淋巴结记忆T细胞可能通过独立机制参与呼吸道免疫保护。鉴于肺Trm在小鼠模型及人类疾病中均被证实具有关键保护作用,评估mRNA初免-加强策略能否在呼吸道黏膜及区域淋巴组织中诱导功能性Trm具有重要临床转化价值。但现有研究显示,肺组织局部抗原暴露是建立有效Trm的必要条件,肌肉注射途径能否突破解剖屏障建立呼吸系统Trm应答,仍需通过设计精巧的体内外实验系统进行验证。
近期,美国明尼苏达大学微生物学与免疫学系免疫学中心研究团队在《Science Immunology》期刊发表原创性研究论文,系统阐释了免疫接种途径对自我扩增型mRNA疫苗诱导肺组织驻留记忆性CD8+和CD4+ T细胞建立的关键调控作用。该研究采用DNA功能化纳米颗粒(MDNP)递送系统包载编码流感病毒核蛋白(NP)的自我扩增mRNA疫苗,深入解析了不同免疫途径对抗原特异性T细胞应答及体液免疫应答的差异化调控机制。研究团队通过构建多维度免疫监测体系,首次揭示了疫苗递送路径与呼吸道黏膜免疫微环境中记忆性T细胞分化、驻留及功能维持的内在关联,为优化mRNA疫苗的黏膜免疫诱导策略提供了重要科学依据。

该研究团队构建了一种靶向甲型流感病毒核蛋白(NP)的自我扩增型mRNA疫苗,其通过树枝状修饰纳米颗粒(MDNP)实现高效递送。研究者系统比较了不同免疫途径(包括对侧与同侧肌肉注射增强、静脉注射及鼻内给药)对流感特异性细胞免疫与体液免疫应答的调控作用,并采用共生外科模型解析了组织特异性记忆T细胞的形成规律。
实验设计显示,初次免疫采用右侧腘绳肌注射5μg编码Cal09流感核蛋白的mRNA,≥28天后分别在同侧(右侧)或对侧(左侧)腘绳肌进行加强免疫。通过MHC I类分子(H-2K^b/NP366-375)和MHC II类分子(I-A^b/NP261-277)四聚体染色技术,研究团队在末次免疫后28天追踪了多组织器官中抗原特异性T细胞应答。结果显示,无论同侧或对侧加强免疫均可显著提升脾脏中H-2K^b/NP366-375+ CD8记忆T细胞的数量。值得注意的是,对侧淋巴结(LN)中记忆性CD8 T细胞的建立呈现部位依赖性,这可能与记忆T细胞表面CD62L表达缺失导致的归巢特性改变相关。
进一步分析显示,肌内免疫途径有效诱导肺组织及引流淋巴结中CD8^+组织驻留记忆T细胞(Trm)的形成,其表型特征为血管外标志物(IV^-)及组织驻留标志物(CD69^+)的共表达。同侧加强免疫策略在提升血清抗体效价方面更具优势,而对侧免疫则促进左髂淋巴结中CD69^+ CD8 T细胞及CD4^+滤泡辅助T细胞(Tfh)记忆群体的形成。鼻内递送途径虽仅诱导适度水平的循环记忆T细胞,但显著增强呼吸道黏膜部位的T细胞分布。值得关注的是,肌内免疫联合鼻内加强的序贯免疫策略,成功实现系统性T细胞记忆与肺组织Trm应答的协同强化。
该研究证实,mRNA疫苗的递送途径通过调控免疫应答的空间分布,同时影响体液免疫与细胞免疫的质量特征。肌内初免-加强方案足以建立肺组织Trm应答,而鼻内加强免疫可进一步优化呼吸道黏膜免疫屏障,这种异源免疫策略为设计针对呼吸道病原体的新一代mRNA疫苗提供了重要理论依据。
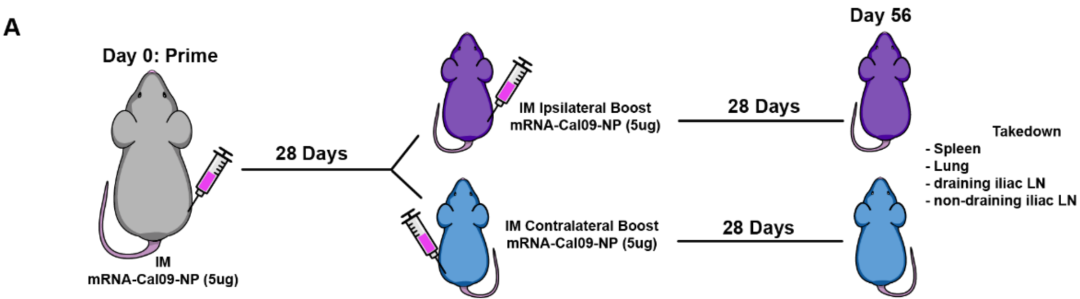
比较不同免疫途径的研究表明,鼻内加强免疫可显著增加肺实质中CD103+CD8 T细胞的募集。尽管异源免疫策略为诱导特定免疫应答提供了有效手段,但人类mRNA疫苗的标准接种方式仍为肌肉注射(IM)。鉴于呼吸道组织对急性炎症的高度敏感性,传统脂质纳米颗粒(LNP)介导的鼻内给药可能引发严重的炎症反应,甚至导致实验动物死亡。本研究采用的改良型树枝状纳米颗粒(MDNP)制剂在鼻内RNA疫苗递送中表现出卓越的安全性,接受IN给药的小鼠全部存活。相较于常规LNP制剂,MDNP经IM途径免疫后,仅诱导极低水平的炎症因子(包括IP-10、IL-6、MCP-1、CXCL1和RANTES),其生物安全性显著优于传统递送系统。
为系统评估不同给药途径对记忆T细胞分化及组织分布的影响,研究者比较了肌肉注射(IM)、静脉注射(IV)及鼻内(IN)三种免疫策略对呼吸道黏膜和肺引流纵隔淋巴结(medLN)中T细胞应答的调控作用。结果显示,IM与IV免疫在次级淋巴器官中诱导的H-2K^b/NP366-375四聚体+ T细胞数量相当,但IV免疫未能有效建立肌肉引流髂淋巴结中的CD62L^-CD69+记忆性CD8 T细胞库。鼻内免疫虽导致脾脏和髂淋巴结中记忆T细胞数量减少,却在medLN中特异性富集记忆T细胞群体。值得注意的是,IN免疫后,IM免疫小鼠髂淋巴结中的medLN H-2K^b/NP366-375四聚体+ T细胞呈现表型复制现象,提示不同免疫途径对T细胞区域化分布存在特异性调控机制。
进一步分析表明,mRNA疫苗接种途径显著影响Tfh细胞分化与肺组织记忆T细胞形成。尽管所有免疫途径均能在引流淋巴结中诱导长寿命Tfh细胞,但肺组织中仅观察到有限的抗原特异性CD4记忆T细胞。鼻内递送策略显著增加肺组织中I-Ab:NP261-277+ CD4 T细胞数量,其表型特征为血管外定位(IV^-)及CD69+表达,但CD103共表达水平相对较低,这与非淋巴组织中CD4 Trm的已知表型特征一致。值得注意的是,与流感病毒感染模型不同,mRNA疫苗接种未能在肺组织中诱导产生具有Tfh样表型(PSGL1^lo FR4^hi)的记忆性CD4 T细胞群体,但IN免疫可诱导产生FR4中间表达群体,其表型特征更接近TH1样驻留记忆T细胞。
为验证肺组织驻留记忆T细胞(Trm)的存在,研究团队采用共生手术模型进行深入解析。尽管CD69常被用作Trm的标志分子,但并非所有CD69+细胞均为组织驻留型,且部分Trm可能不表达CD69。通过比较免疫小鼠与同种异体对照小鼠的抗原特异性T细胞分布,发现肺血管外间隙中NP366+ CD8 T细胞主要存在于免疫组,表明IM免疫途径可诱导产生功能性Trm。进一步表型分析显示,CD69^-CD103^-、CD69+CD103^-及CD69+CD103+三个亚群中组织驻留T细胞比例呈梯度增加(40%至95%至100%)。鼻内加强免疫不仅使血管外肺T细胞数量增加约10倍,更将组织驻留比例从70%提升至90%。对于CD4 T细胞,IN免疫后约90%的I-Ab:NP261-277+细胞在肺组织中驻留,若限定分析CD69+亚群,则100%表现为组织驻留特征。这些数据证实,无论通过何种途径免疫,mRNA疫苗均可有效诱导肺组织Trm形成,而鼻内加强策略可进一步优化其驻留效能。
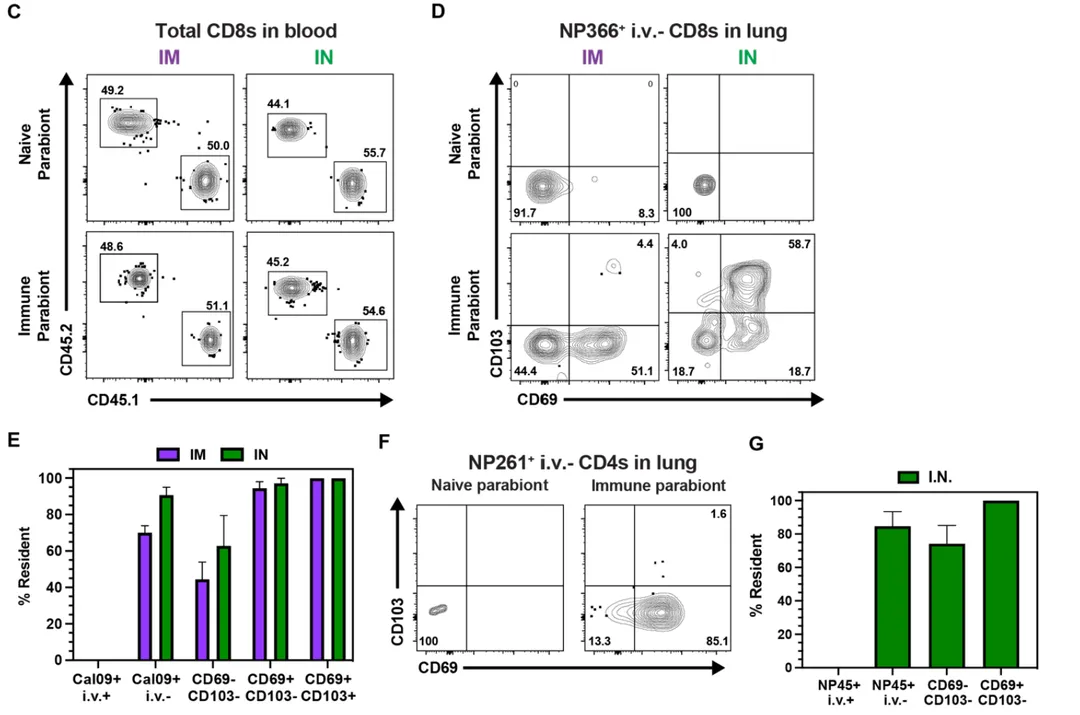
将肌肉内免疫与鼻内mRNA增强相结合,实现循环记忆和肺Trm的高水平
尽管单纯IM免疫策略可诱导产生高水平的循环NP366+ CD8 T细胞,但IN免疫途径更有利于肺Trm的分化成熟。研究团队进一步探索了(1)抗原特异性记忆T细胞维持肺Trm库容量的潜能;(2)是否可通过IM初免-IN加强的序贯免疫策略,同步实现系统性T细胞记忆与肺组织Trm应答的最大化。相较于单一IM初免-加强方案,IN加强免疫显著提升了脾脏、肠系膜淋巴结及肺组织(经静脉注射途径)中抗原特异性CD8+和CD4+ T细胞的绝对数量,但髂淋巴结中未观察到类似扩增效应。值得注意的是,IN加强策略特异性增强了肺血管外间隙中CD69+CD103+ CD8 T细胞及CD69+ CD4 T细胞的表型丰度与组织驻留特征。这些数据表明,IM初免联合IN加强的异源免疫方案,可协同诱导高水平循环记忆T细胞与肺组织Trm应答。
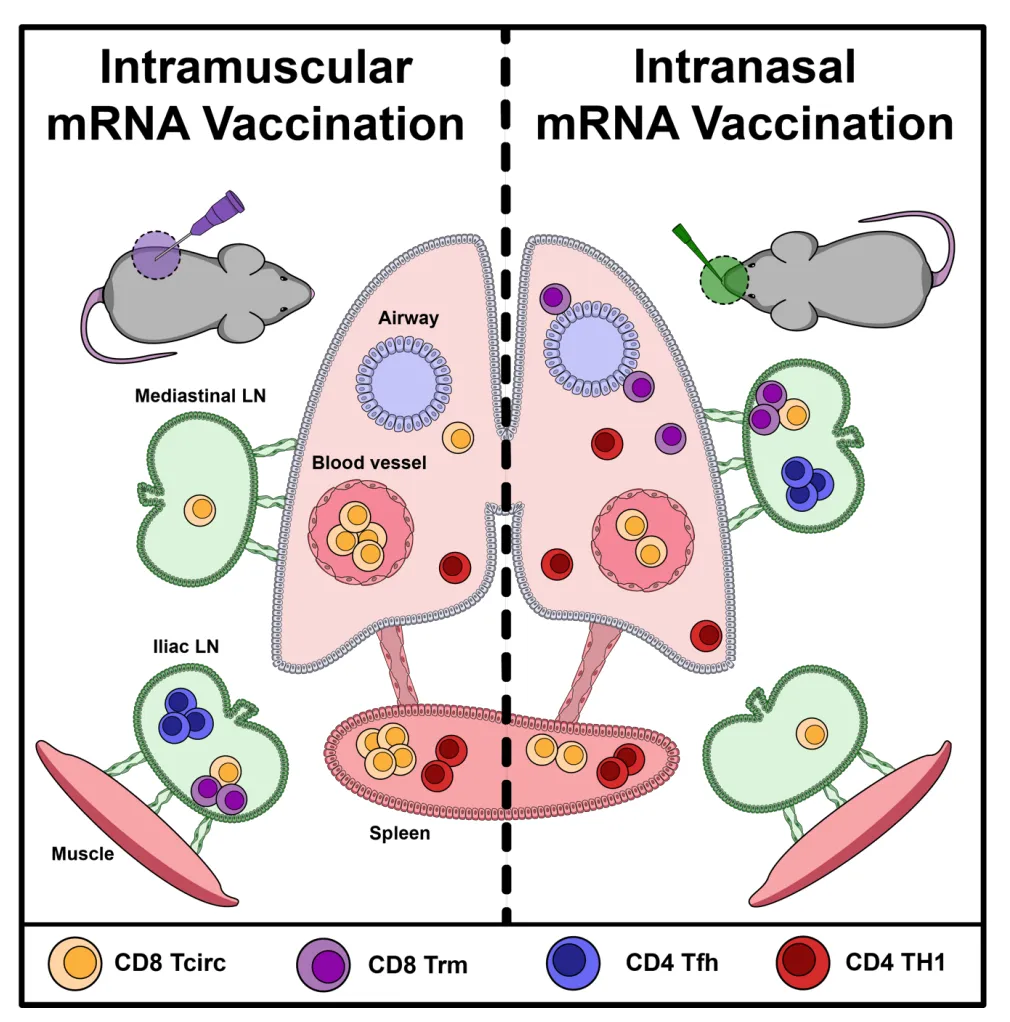
综上所述,本研究系统解析了mRNA疫苗诱导的抗原特异性CD8+与CD4+记忆T细胞的丰度特征、表型异质性及解剖学分布规律。研究证实,无论采用何种免疫途径,mRNA疫苗均可有效建立肺组织Trm应答,这种前沿细胞免疫机制为抵御呼吸道感染性疾病提供了关键保护屏障。因此,mRNA疫苗技术完全契合通用流感疫苗的核心设计标准——在病原体入侵门户部位构建持久的细胞免疫记忆。鉴于RNA疫苗平台具备快速扩展编码任意蛋白抗原的技术优势,且不受载体预存免疫限制,未来需进一步开展多维度免疫原性评价,以全面揭示其诱导广谱保护性免疫应答的分子机制。
相关产品推荐
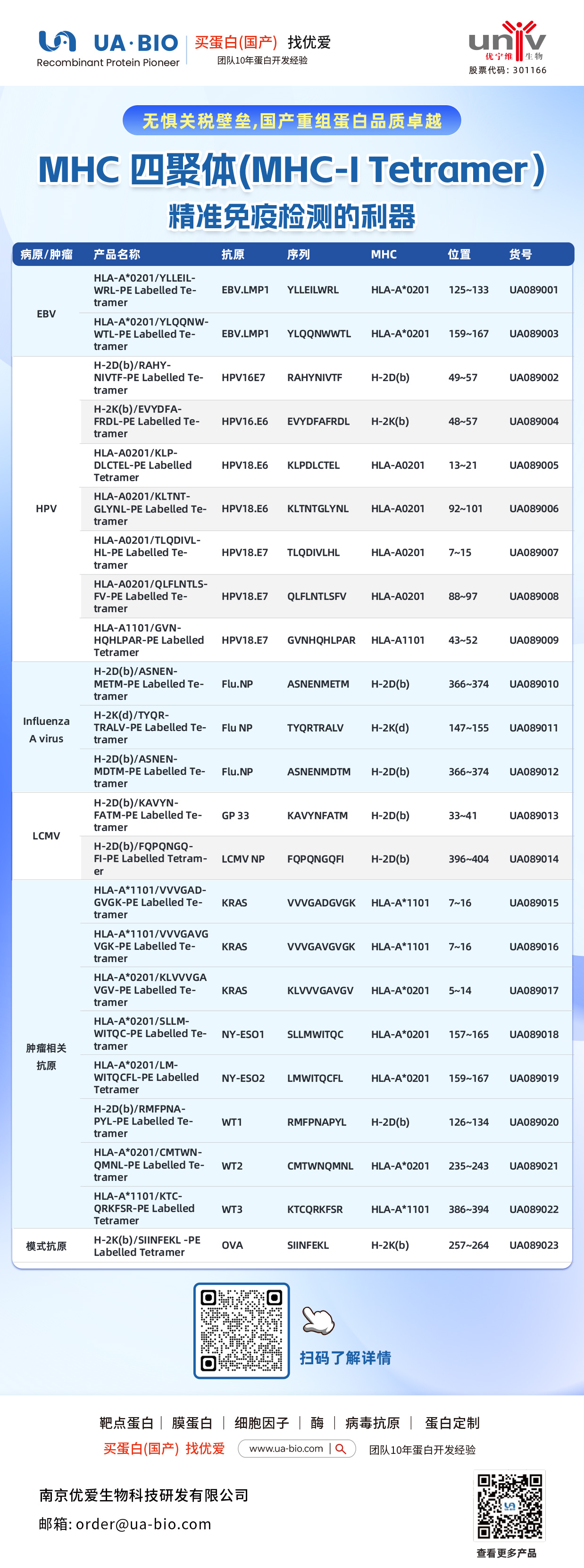
| 病原/肿瘤 | 产品名称 | 抗原 | 序列 | MHC | 位置 | 货号 |
| EBV | HLA-A*0201/YLELLVWRL-PE Labelled Tetramer | EBV.LMP1 | YLELLVWRL | HLA-A*0201 | 125-133 | UA089001 |
| EBV | HLA-A*0201/YLQQNWTL-PE Labelled Tetramer | EBV.LMP1 | YLQQNWTL | HLA-A*0201 | 159-167 | UA089003 |
| EBV | H-2Db(b)/RAHY-NIVTF-PE Labelled Tetramer | HPV16.E7 | RAHYNIVTF | H-2Db | 49-57 | UA089002 |
| HPV | H-2K(b)/EVYDFA-FRQL-PE Labelled Tetramer | HPV16.E6 | EVYDFARDL | H-2Kb | 48-57 | UA089004 |
| HPV | HLA-A*0201/KLP-DLCTL-PE Labelled Tetramer | HPV18.E6 | KLPDCTL | HLA-A*0201 | 13-21 | UA089005 |
| HPV | HLA-A*0201/KLTNT-GLYQL-PE Labelled Tetramer | HPV18.E6 | KLTNTGLYNL | HLA-A*0201 | 92-101 | UA089006 |
| HPV | HLA-A*0201/TLODIVIHL-PE Labelled Tetramer | HPV18.E7 | TLODIVIHL | HLA-A*0201 | 7~15 | UA089007 |
| HPV | HLA-A*0201/QFLNTL-FV-PE Labelled Tetramer | HPV18.E7 | QFLNTLFSV | HLA-A*0201 | 88-97 | UA089008 |
| HPV | HLA-A*1101/GVNHQLPAR-PE Labelled Tetramer | HPV18.E7 | GVNHQLPAR | HLA-A*1101 | 43-52 | UA089009 |
| Influenza A Virus | H-2D(b)/ASNENMETM-PE Labelled Tetramer | Flu.NP | ASNENMETM | H-2Db | 366-374 | UA089010 |
| Influenza A Virus | H-2K(d)/TYQR-TRALY-PE Labelled Tetramer | Flu.NP | TYQRTRALY | H-2Kd | 147-155 | UA089011 |
| Influenza A Virus | H-2D(b)/ASNEN-MDTM-PE Labelled Tetramer | Flu.NP | ASNENMDTM | H-2Db | 366-374 | UA089012 |
| LCMV | H-2D(b)/KAVYNFATM-PE Labelled Tetramer | GP 33 | KAVYNFATM | H-2Db | 33-41 | UA089013 |
| LCMV | H-2D(b)/FQPGQGFVK-PE Labelled Tetramer | LCMV NP | FQPGQGFVK | H-2Db | 396-404 | UA089014 |
| Tumor-related | HLA-A*1101/VVGADGVK-PE Labelled Tetramer | KRAS | VVGADGVK | HLA-A*1101 | 7~16 | UA089015 |
| Tumor-related | HLA-A*1101/VVGAGVGK-PE Labelled Tetramer | KRAS | VVGAGVGK | HLA-A*1101 | 7~16 | UA089016 |
| Tumor-related | HLA-A*0201/KLVVGAGV-PE Labelled Tetramer | KRAS | KLVVGAGV | HLA-A*0201 | 5~14 | UA089017 |
| Tumor-related | HLA-A*0201/SLLMWITQC-PE Labelled Tetramer | NY-ESO1 | SLLMWITQC | HLA-A*0201 | 157-165 | UA089018 |
| Melanoma | HLA-A*0201/LMWITQCFL-PE Labelled Tetramer | NY-ESO2 | LMWITQCFL | HLA-A*0201 | 159-167 | UA089019 |
| Melanoma | H-2Db(b)/MMFPNA-P1-PE Labelled Tetramer | WT1 | RMFPNAPL | H-2Db | 126-134 | UA089020 |
| Melanoma | HLA-A*0201/CMTWV-PE Labelled Tetramer | WT2 | CMTWVNMDM | HLA-A*0201 | 235-243 | UA089021 |
| Melanoma | HLA-A*1101/KTCQRKSF-PE Labelled Tetramer | WT3 | KTCQRKSF | HLA-A*1101 | 386-394 | UA089022 |
| Ovarian Cancer | H-2K(b)/SINFEKL-PE Labelled Tetramer | OVA | SINFEKL | H-2Kb | 257-264 | UA089023 |