LCMV MHC四聚体技术突破:驱动Immuno-STAT平台精准激活与选择性扩增抗原特异性T细胞
抗原特异性(AgS)T细胞的靶向药物激活为突破现有T细胞疗法瓶颈提供了创新路径。本研究构建了两种免疫治疗平台——Immuno-STAT与Neo-STAT,通过将共刺激配体与多肽-HLA(pHLA)复合物精准递送至AgS T细胞,实现肿瘤特异性免疫应答的选择性调控。
- 最新进展
- 产品信息
LCMV MHC四聚体技术
抗原特异性(AgS)T细胞的靶向药物激活为突破现有T细胞疗法瓶颈提供了创新路径。本研究构建了两种免疫治疗平台——Immuno-STAT与Neo-STAT,通过将共刺激配体与多肽-HLA(pHLA)复合物精准递送至AgS T细胞,实现肿瘤特异性免疫应答的选择性调控。基于该平台部署的亲和力优化型IL-2变体,在体外实验中展现出对寡克隆及多功能AgS T细胞的特异性扩增能力,并与CD80信号通路产生协同效应,其增殖效率显著优于传统多肽刺激模式。
过继T细胞疗法的临床转化瓶颈
尽管过继T细胞疗法(ACT)通过患者自体T细胞体外激活与TCR改造已取得显著临床进展,但其广泛应用仍受制于复杂的细胞制备工艺、严格的回输操作要求、个体化患者预处理方案及潜在安全风险。相较之下,系统性共刺激策略作为可扩展的药理学干预手段,旨在直接激活患者体内肿瘤特异性T细胞,但现有尝试(如抗CD137抗体联合高剂量IL-2)因严重毒性反应(包括血管渗漏综合征、细胞因子风暴)而临床应用受限。
IL-2疗法的疗效与毒性悖论
IL-2作为经典免疫调节因子,虽可诱导CD8⁺效应T细胞(Teff)及NK、B细胞增殖分化,且在转移性肾细胞癌和黑色素瘤中实现部分患者完全缓解,但其剂量依赖性毒性(如血管渗漏综合征)及调节性T细胞(Treg)扩增风险严重限制临床应用。Treg因高表达IL-2高亲和力受体(CD25),在IL-2刺激下优先增殖,抑制Teff抗肿瘤效应,并与癌症患者预后不良直接相关。此外,CTLA-4与PD-1抑制剂联合治疗虽显著增强T细胞反应,但毒性叠加效应亦限制其组合应用。
靶向递送策略破解免疫治疗困境
癌症疫苗等可扩展疗法虽具潜力,但其疗效高度依赖抗原提呈细胞(APC)功能完整性,包括抗原加工、共刺激信号传递及肿瘤微环境耐受性。树突状细胞(DC)作为核心APC,虽可通过递呈pHLA及CD80/CD86等共刺激分子启动抗肿瘤CD8⁺ T细胞应答,但其表面抑制性受体(如PD-L1、TIM-3)及肿瘤微环境免疫抑制因子(如TGF-β、IDO)显著削弱治疗效力。因此,开发非APC依赖型、靶向性免疫调控手段成为突破临床瓶颈的关键。
Immuno-STAT/Neo-STAT平台技术革新
本研究设计的Immuno-STAT与Neo-STAT平台基于天然T细胞调控机制,通过Fc融合蛋白架构实现信号精准递送(图1a)。该平台由多肽表位、MHC I类分子、共调节分子及Fc段组成,通过多价结合模式激活同源T细胞。其模块化设计允许共刺激配体(如CD80、4-1BBL)或共抑制配体(如PD-L1)灵活融合至MHC-Fc重链或β2微球蛋白(β2m)末端,实现信号分子空间构象与化学计量比的精准调控。
IL-2优化变体实现选择性T细胞扩增
平台初步验证聚焦IL-2作为共调节分子,通过亲和力优化降低其与Treg表面CD25的结合能力,同时保留对Teff中间亲和力IL-2R(CD122/CD132)的激活效能。体外实验证实,该IL-2变体可选择性扩增AgS CD8⁺ Teff细胞,诱导其表达多功能效应分子(如IFN-γ、Granzyme B),并与CD80信号产生协同增效,其增殖效率较传统多肽刺激提升3-5倍。
平台优势与临床转化前景
相较于传统系统性免疫刺激,Immuno-STAT/Neo-STAT平台通过以下机制实现安全增效:
- 靶向递送:Fc段介导的pHLA-TCR结合确保信号分子局部富集,减少非特异性激活;
- 信号整合:共刺激分子与IL-2变体共定位形成免疫突触样结构,模拟天然T细胞激活模式;
- 耐药性突破:绕过APC功能缺陷及肿瘤微环境抑制,直接激活静息态AgS T细胞。
该平台为开发新一代肿瘤免疫治疗药物提供了创新范式,其模块化设计亦支持快速迭代优化,有望通过替换表位或共刺激分子应对肿瘤异质性及耐药突变。

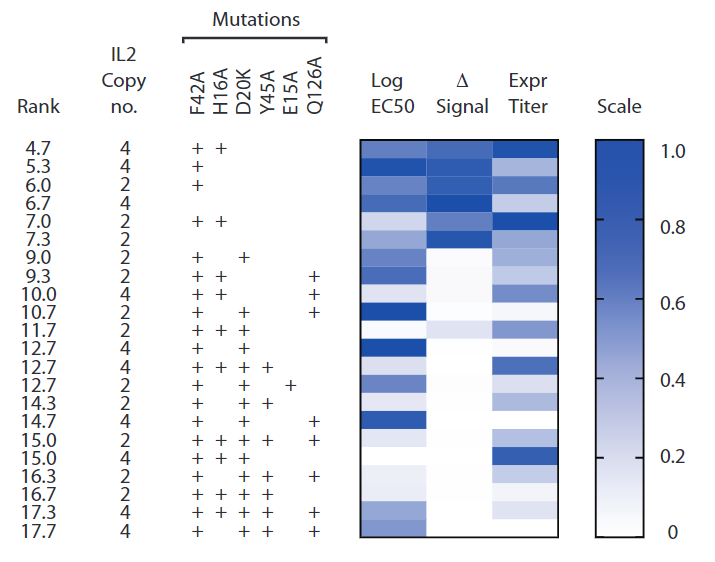
基于IL-2的Immuno-STAT框架优化与构建体评估
为优化基于IL-2的Immuno-STAT框架设计,本研究系统评估了系列构建体的相对效力、抗原特异性(AgS)选择性及工业化制备可行性。候选构建体以LCMV gp33-41/H-2Db表位-MHC复合物为核心骨架,通过N端融合人IL-2突变体、C端连接效应功能减弱型小鼠IgG2a Fc段构建而成。设计策略包含双重优化:
- IL-2功能改造:引入IL-2减弱突变(F42A/H16A),以降低IL-2Rα依赖性毒性及Treg结合亲和力,同时保留对IL-2Rβ/γ中间亲和力受体的激活效能;
- 化学计量比调控:将IL-2拷贝数限定为2或4个单元,避免因过度融合导致的蛋白表达滴度骤降(图S2)。
体外功能验证与筛选
人源化IL-2变体在人源及鼠源细胞系中均表现出强效活性,可通过诱导STAT5磷酸化(pSTAT5)反映IL-2R信号通路的激活程度,该指标与T细胞增殖及表型标志物表达呈显著正相关。为评估构建体性能,采用AgS P14 TCR转基因小鼠及非AgS C57BL/6小鼠的脾脏CD8⁺ T细胞进行平行实验,通过以下参数对构建体进行排序:
- 效力指数:AgS P14 T细胞pSTAT5信号的半数有效浓度对数(logEC50-P14);
- 选择性指数:AgS P14细胞与非AgS C57BL/6细胞EC50差值(ΔlogEC50);
- 可制造性评分:基于蛋白表达滴度及纯化产率。
初筛结果显示,LCMV-IST-IL2.FH4构建体综合性能最优,其次为LCMV-IST-IL2.F4(图S3)。进一步剂量梯度验证(图1b)表明:
- AgS效力无显著差异:LCMV-IST-IL2.FH4、LCMV-IST-IL2.F4、LCMV-IST-IL2.2(2拷贝野生型IL-2)及LCMV-IST-IL2.4(4拷贝野生型IL-2)在诱导AgS P14 T细胞pSTAT5信号的logEC50值未见统计学差异;
- 非AgS背景信号相似:上述构建体对非AgS C57BL/6 T细胞的激活效力(logEC50-B6)亦无显著差异;
- 选择性评估一致:通过AgS细胞50%最大pSTAT5信号与非AgS细胞EC50差值(ΔEC50)及logEC50差异(ΔlogEC50)两种方法测得的选择性参数,在各构建体间均未显示显著区别。
结构-功能关系解析
尽管F42A/H16A突变预期会降低IL-2R信号强度,但实验数据显示,当IL-2拷贝数增加时(如LCMV-IST-IL2.4 vs. LCMV-IST-IL2.2),其AgS效力及选择性未出现预期中的下降。推测该现象可能源于以下机制:
- 多价结合补偿效应:高拷贝IL-2通过空间位阻效应增强与AgS T细胞的局部结合能力,部分抵消了单分子亲和力降低的影响;
- 信号整合优势:pMHC-TCR结合触发的免疫突触形成,可能促进IL-2变体在T细胞表面的富集,从而放大其生物活性。
综上,LCMV-IST-IL2.FH4构建体凭借其平衡的效力、选择性及可制造性,被选定为后续研究的优先候选分子,其设计原则为开发新一代肿瘤靶向免疫调节剂提供了重要参考。

人源化Immuno-STAT平台功能验证与模块化扩展
为验证人源化Immuno-STAT框架的临床转化潜力,研究构建了整合IL-2.FH4变体、效应功能减弱型人IgG1 Fc段、HLA-A*0201分子及模型抗原表位(CMV pp65₄₉₅-₅₀₃或MART1₂₆-₃₅)的复合体(图1c)。通过体外共培养人外周血单个核细胞(PBMC)与特异性Immuno-STAT分子,系统评估了抗原特异性CD8⁺ T细胞的扩增效率及功能特征。
IL-2.FH4依赖性T细胞扩增验证
双四聚体染色显示,经CMV-IST-IL2.FH4刺激的PBMC中,CMV特异性CD8⁺ T细胞频率显著升高(>30倍),而缺失IL-2融合模块的CMV-IST组未检测到特异性扩增(图1d)。进一步补充外源性重组人IL-2(野生型)可部分恢复CMV-IST的扩增能力,证实IL-2R信号通路激活是T细胞增殖的必要条件。类似地,MART1-IST-IL2.FH4亦诱导MART1特异性CD8⁺ T细胞显著扩增(图1e),且扩增效率与抗原表位亲合力无关,表明平台兼容不同肿瘤相关抗原。
多功能效应T细胞分化特征
扩增后的抗原特异性CD8⁺ T细胞均表现出强烈的多功能效应分子共表达特征:
- 细胞毒标志物:>75%的细胞同时表达IFN-γ、TNF-α、颗粒酶B及脱颗粒标志物CD107a(图1f),其比例与多肽刺激组相当;
- 抗原特异性激活:无关多肽刺激下,除颗粒酶B外(基础表达量<5%),其余功能分子表达均接近本底水平;
- 剂量依赖性:Immuno-STAT与多肽刺激组在功能分子表达阈值及剂量反应曲线上高度一致,提示其诱导的T细胞具备与天然应答相似的效应强度。
寡克隆TCR谱系保真性
单细胞TCR测序证实,Immuno-STAT扩增的抗原特异性CD8⁺ T细胞保持了与多肽刺激组一致的寡克隆特征(图1g):
- CMV表位:两组间优势克隆型序列完全一致,频谱分布相似;
- MART1表位:因初始前体频率较低,均呈现低克隆性扩增,但TCRβ链CDR3区序列高度重合。
模块化平台兼容性与共刺激配体库扩展
Immuno-STAT框架展现出卓越的模块化适配能力:
- 共刺激分子集成:除IL-2外,CD80、CD86、CD137L等共刺激配体可灵活融合至MHC-Fc骨架,形成共刺激信号组合库;
- HLA等位基因扩展:成功构建AFP₄₀₃-₄₁₁/HLA-A1101及HBVp₁₀₉-₁₁₈/HLA-A2402等复合体,验证了平台对非HLA-A*0201表位的展示能力;
- 低亲和力表位处理:针对HLA结合力弱的肿瘤相关抗原(如KRAS G12D),开发了Neo-STAT技术,通过位点特异性化学连接将表位加载至预成型“空载”HLA分子,突破了基因融合表达的局限性(图2b)。
共刺激信号协同效应初探
以CMV表位为模型,评估了CD80共刺激分子与IL-2.FH4的协同作用:
- 单药活性:CMV-IST-CD80-2单独使用未能诱导显著T细胞增殖;
- 联合刺激:CMV-IST-CD80-2与CMV-IST-IL2.FH4联用时,T细胞扩增效率较单药组提升2.3倍,且显著优于传统多肽刺激(图2d),提示共刺激信号整合可进一步放大治疗效应。
综上,Immuno-STAT/Neo-STAT平台通过精准的信号分子空间排列及模块化设计,实现了对抗原特异性T细胞的高效、选择性扩增,其兼容的共刺激配体库及表位展示系统为开发新一代个体化肿瘤免疫治疗药物奠定了技术基础。
相关产品推荐
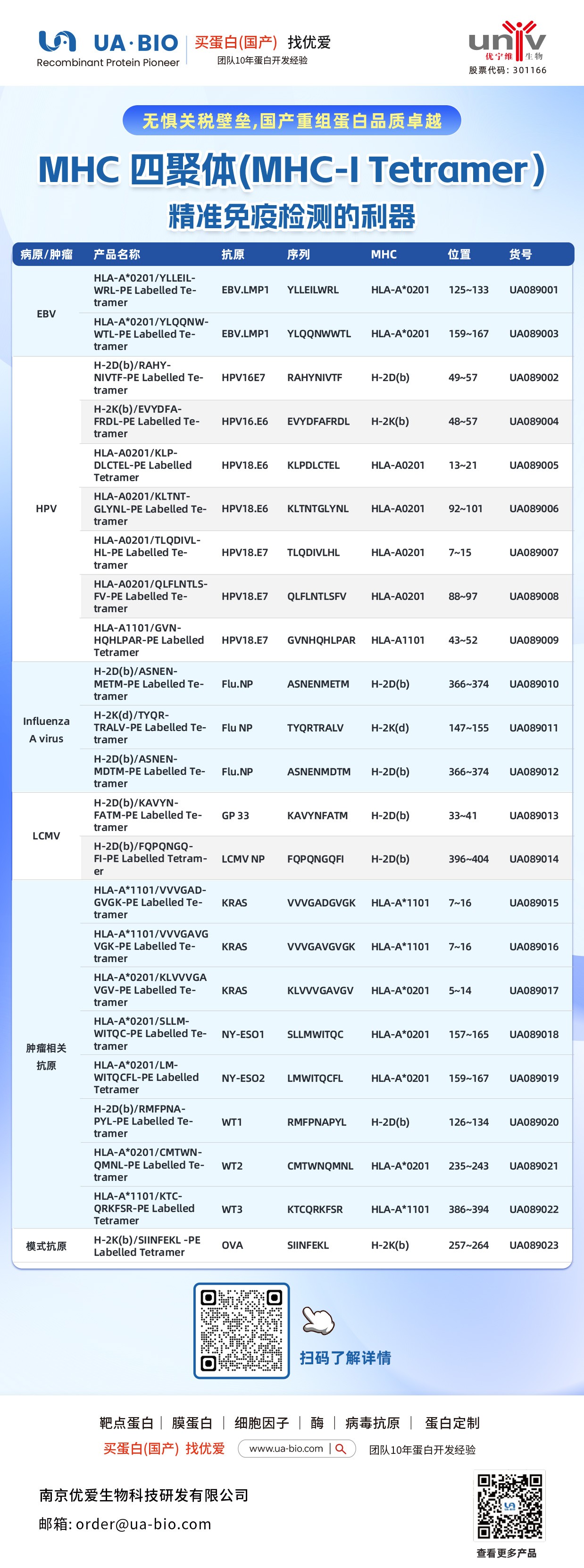
| 病原/肿瘤 | 产品名称 | 抗原 | 序列 | MHC | 位置 | 货号 |
| EBV | HLA-A*0201/YLELLVWRL-PE Labelled Tetramer | EBV.LMP1 | YLELLVWRL | HLA-A*0201 | 125-133 | UA089001 |
| EBV | HLA-A*0201/YLQQNWTL-PE Labelled Tetramer | EBV.LMP1 | YLQQNWTL | HLA-A*0201 | 159-167 | UA089003 |
| EBV | H-2Db(b)/RAHY-NIVTF-PE Labelled Tetramer | HPV16.E7 | RAHYNIVTF | H-2Db | 49-57 | UA089002 |
| HPV | H-2K(b)/EVYDFA-FRQL-PE Labelled Tetramer | HPV16.E6 | EVYDFARDL | H-2Kb | 48-57 | UA089004 |
| HPV | HLA-A*0201/KLP-DLCTL-PE Labelled Tetramer | HPV18.E6 | KLPDCTL | HLA-A*0201 | 13-21 | UA089005 |
| HPV | HLA-A*0201/KLTNT-GLYQL-PE Labelled Tetramer | HPV18.E6 | KLTNTGLYNL | HLA-A*0201 | 92-101 | UA089006 |
| HPV | HLA-A*0201/TLODIVIHL-PE Labelled Tetramer | HPV18.E7 | TLODIVIHL | HLA-A*0201 | 7~15 | UA089007 |
| HPV | HLA-A*0201/QFLNTL-FV-PE Labelled Tetramer | HPV18.E7 | QFLNTLFSV | HLA-A*0201 | 88-97 | UA089008 |
| HPV | HLA-A*1101/GVNHQLPAR-PE Labelled Tetramer | HPV18.E7 | GVNHQLPAR | HLA-A*1101 | 43-52 | UA089009 |
| Influenza A Virus | H-2D(b)/ASNENMETM-PE Labelled Tetramer | Flu.NP | ASNENMETM | H-2Db | 366-374 | UA089010 |
| Influenza A Virus | H-2K(d)/TYQR-TRALY-PE Labelled Tetramer | Flu.NP | TYQRTRALY | H-2Kd | 147-155 | UA089011 |
| Influenza A Virus | H-2D(b)/ASNEN-MDTM-PE Labelled Tetramer | Flu.NP | ASNENMDTM | H-2Db | 366-374 | UA089012 |
| LCMV | H-2D(b)/KAVYNFATM-PE Labelled Tetramer | GP 33 | KAVYNFATM | H-2Db | 33-41 | UA089013 |
| LCMV | H-2D(b)/FQPGQGFVK-PE Labelled Tetramer | LCMV NP | FQPGQGFVK | H-2Db | 396-404 | UA089014 |
| Tumor-related | HLA-A*1101/VVGADGVK-PE Labelled Tetramer | KRAS | VVGADGVK | HLA-A*1101 | 7~16 | UA089015 |
| Tumor-related | HLA-A*1101/VVGAGVGK-PE Labelled Tetramer | KRAS | VVGAGVGK | HLA-A*1101 | 7~16 | UA089016 |
| Tumor-related | HLA-A*0201/KLVVGAGV-PE Labelled Tetramer | KRAS | KLVVGAGV | HLA-A*0201 | 5~14 | UA089017 |
| Tumor-related | HLA-A*0201/SLLMWITQC-PE Labelled Tetramer | NY-ESO1 | SLLMWITQC | HLA-A*0201 | 157-165 | UA089018 |
| Melanoma | HLA-A*0201/LMWITQCFL-PE Labelled Tetramer | NY-ESO2 | LMWITQCFL | HLA-A*0201 | 159-167 | UA089019 |
| Melanoma | H-2Db(b)/MMFPNA-P1-PE Labelled Tetramer | WT1 | RMFPNAPL | H-2Db | 126-134 | UA089020 |
| Melanoma | HLA-A*0201/CMTWV-PE Labelled Tetramer | WT2 | CMTWVNMDM | HLA-A*0201 | 235-243 | UA089021 |
| Melanoma | HLA-A*1101/KTCQRKSF-PE Labelled Tetramer | WT3 | KTCQRKSF | HLA-A*1101 | 386-394 | UA089022 |
| Ovarian Cancer | H-2K(b)/SINFEKL-PE Labelled Tetramer | OVA | SINFEKL | H-2Kb | 257-264 | UA089023 |