- 最新进展
- 产品信息
FOLR1:卵巢癌靶向治疗中的新兴靶点与CAR-T技术潜力
上皮性卵巢癌(OvCa)作为女性生殖系统中最致命的恶性肿瘤之一,因其早期诊断困难、复发率高及五年生存率较低,成为肿瘤学领域亟待攻克的难题。近年来,随着分子生物学与免疫治疗技术的快速发展,叶酸受体1(FOLR1,亦称FRα)因其在上皮性肿瘤中的特异性表达,逐渐成为卵巢癌靶向治疗研究的热点。
FOLR1的生物学特性与表达模式
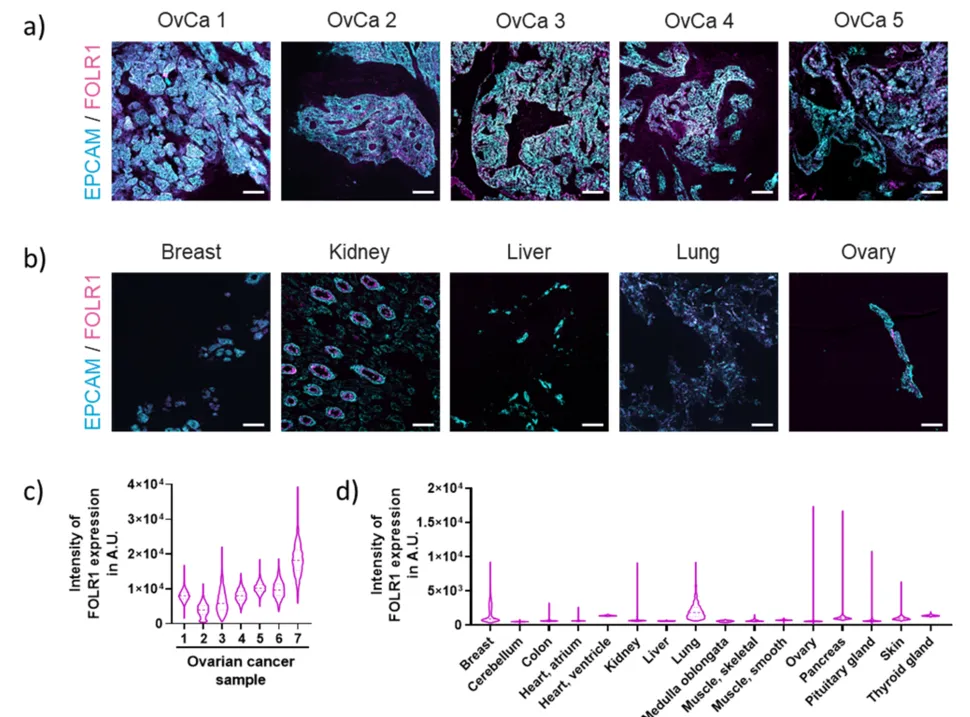
FOLR1是一种糖基磷脂酰肌醇(GPI)锚定的膜蛋白,通过转运叶酸参与细胞增殖与代谢过程。其在卵巢癌等上皮性肿瘤中呈现异常高表达,而在正常组织中表达水平极低,这一特性使其成为理想的肿瘤特异性靶点。研究显示,在高级别浆液性卵巢癌(HGSOC)中,FOLR1的表达率接近100%,且表达强度与肿瘤恶性程度正相关。这种差异表达模式不仅为卵巢癌的早期诊断提供了潜在标志物,更为靶向治疗策略的开发奠定了分子基础。
FOLR1作为CAR-T靶点的验证
嵌合抗原受体T细胞(CAR-T)技术通过基因工程改造T细胞,使其能够特异性识别并杀伤肿瘤细胞。在FOLR1靶向CAR-T治疗的研究中,研究者通过构建多种CAR结构,筛选出对FOLR1具有高亲和力和特异性的候选分子。这些CAR-T细胞在体外实验中展现出对FOLR1阳性卵巢癌细胞的强大杀伤活性,同时对FOLR1阴性细胞无显著毒性,初步验证了其安全性与有效性。此外,动物模型实验进一步证实,FOLR1靶向CAR-T细胞能够有效抑制肿瘤生长并延长生存期,表明其在卵巢癌治疗中的巨大潜力。
CAR-T技术优化与挑战
尽管FOLR1靶向CAR-T治疗展现出显著疗效,但其临床应用仍面临多重挑战。首先,CAR结构的优化需平衡亲和力与安全性,避免非特异性激活导致的脱靶毒性。其次,肿瘤微环境中的免疫抑制因素(如Treg细胞、PD-L1表达)可能削弱CAR-T细胞的持久性与功能。因此,联合免疫检查点抑制剂或改造CAR-T细胞以增强其抗耗竭能力成为当前研究的重要方向。此外,如何提高CAR-T细胞在实体瘤中的浸润与穿透能力,亦是突破卵巢癌治疗瓶颈的关键。
未来展望
FOLR1作为卵巢癌治疗的特异性靶点,结合CAR-T技术的精准性与高效性,为突破现有治疗局限提供了新的可能。随着基因编辑技术(如CRISPR/Cas9)与合成生物学的发展,未来可通过工程化改造CAR-T细胞,实现多靶点协同识别、动态调控功能及长期记忆形成,进一步提升其抗肿瘤活性。此外,基于FOLR1的纳米载体递送系统或双特异性抗体设计,亦可能为卵巢癌治疗开辟新的途径。
FOLR1靶向CAR-T技术为卵巢癌治疗带来了革命性突破,其特异性表达模式与CAR-T技术的结合,不仅为解决卵巢癌复发与耐药问题提供了新策略,更为肿瘤免疫治疗领域的发展注入了新的活力。随着研究的深入与技术的完善,FOLR1有望成为卵巢癌精准治疗的核心靶点。