- 最新进展
- 产品信息
最新进展
IL-4 在肿瘤免疫逃逸中的调控作用及机制研究进展
一、肿瘤免疫逃逸的免疫微环境特征
在肿瘤发生发展过程中,机体免疫系统与肿瘤细胞之间的动态平衡被打破,肿瘤通过重塑免疫微环境实现免疫逃逸。这一过程伴随着免疫系统的系统性改变:在髓系细胞中,骨髓祖细胞群、抑制性未成熟单核细胞及中性粒细胞被异常动员进入血液循环;在淋系细胞中,CD4⁺调节性 T 细胞(Treg)和调节性 B 细胞的全身频率显著增加,其中 Treg 细胞在浸润肿瘤组织前已在外周发生特异性克隆扩增。与此同时,树突状细胞及 CD8⁺、CD4⁺T 细胞的数量及 T 细胞受体库多样性明显降低,导致抗肿瘤免疫应答功能受损。
动物模型研究进一步证实了这些免疫异常特征:肿瘤荷瘤小鼠出现幼稚中性粒细胞、单核细胞和树突状细胞的异常累积,而具有抗原提呈功能的树突状细胞和效应 T 细胞群丰度显著下降。作为肿瘤与外周免疫系统沟通的关键枢纽,引流淋巴结表现出单核细胞和树突状细胞频率增加、CD8⁺T 细胞数量减少的特征,提示局部免疫监视功能已被肿瘤破坏。这些研究表明,未成熟髓系细胞的异常累积是肿瘤实现免疫逃逸的重要策略之一,但其上游调控机制尚未完全阐明。
二、IL-4 在肿瘤进展中的作用发现
2023 年 10 月,美国西奈山伊坎医学院 Miriam Merad 教授团队在《Nature》期刊发表的研究揭示了细胞因子 IL-4 通过调控骨髓造血过程促进肿瘤免疫逃逸的新机制,为理解肿瘤 - 骨髓轴的相互作用提供了重要见解。该研究发现 IL-4 是肿瘤浸润单核细胞源巨噬细胞(mo-mac)的主要驱动因子,明确了骨髓来源的 IL-4 通过作用于粒 - 单核细胞祖细胞,诱导免疫抑制性骨髓细胞生成的具体机制,并探讨了 IL-4 作为免疫检查点阻断联合治疗靶点的潜在临床价值。
研究团队前期通过单细胞 RNA 测序技术绘制了人类和小鼠非小细胞肺癌(NSCLC)病变的免疫景观图谱,鉴定出一群具有免疫抑制功能的新型髓系细胞 —— 富含调节分子的成熟树突细胞(mregDC)。深入研究发现,IL-4 与 mregDC 的调控密切相关,阻断 IL-4 信号可显著降低原位 KrasG12DTP53⁻/⁻(KP)肺腺癌模型小鼠和 B16 黑色素瘤肺转移模型小鼠的肺肿瘤负荷,证实了 IL-4 在肿瘤进展中的促进作用。
为明确 IL-4 作用的靶细胞类型,研究人员构建了多种条件性敲除小鼠模型:特异性敲除树突细胞 IL-4 受体 IL-4Rα、组织驻留树突状细胞 IL-4Rα 或 T 细胞 IL-4Rα 的小鼠,其肿瘤负荷均未发生明显变化。这一结果提示,必然存在其他免疫细胞类型通过响应 IL-4 信号促进肿瘤发展,为后续研究指明了方向。
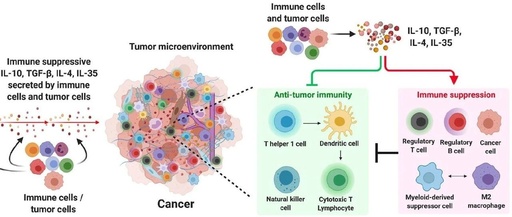
三、IL-4 作用靶细胞的鉴定
基于上述发现,研究人员对人类和小鼠 NSCLC 转录数据集进行深入分析,聚焦于肺癌浸润的单核 - 巨噬细胞和组织驻留单核细胞的差异表达基因。基因集富集分析(GSEA)结果显示,IL-4 信号通路在人类单核细胞源巨噬细胞(mo-mac)特异性基因中富集程度最高,在小鼠模型中富集程度位居第二,提示单核 - 巨噬细胞谱系可能是 IL-4 的关键靶细胞群。
为验证这一假设,研究人员将 Il4ra-floxed 小鼠与 Ms4a3-cre 小鼠杂交,构建了粒 - 单核细胞祖细胞(GMP)特异性 IL-4Rα 缺失模型。Ms4a3 在骨髓粒 - 单核细胞祖细胞中高表达,其驱动的 Cre 重组可在所有下游细胞谱系(单核细胞、mo-mac 和中性粒细胞)中诱导基因缺失,同时保留组织驻留单核细胞的 IL-4Rα 表达。动物实验结果显示,与野生型对照小鼠相比,Il4raΔMs4a3 小鼠的肿瘤负荷降低 85%,表明粒 - 单核细胞谱系的 IL-4 信号是肿瘤进展的关键调控因素。进一步研究发现,荷瘤 Il4raΔMs4a3 小鼠的肺脏 mo-mac 数量和循环单核细胞数量显著减少,证实单核细胞 - mo-mac 谱系是 IL-4 促进肿瘤发展的核心效应细胞。
四、IL-4 调控肿瘤微环境的分子机制
通过对两种基因型荷瘤小鼠骨髓细胞的单细胞 RNA 测序分析,研究团队捕获了所有预期的免疫细胞群体,包括 Trem2 低表达和高表达的两个 mo-mac 亚群(mo-mac I 和 mo-mac II)。分析发现,每个 mo-mac 亚群在 Il4raΔMs4a3 小鼠中均呈现显著的基因表达差异,提示 IL-4Rα 缺失可重塑单核 - 巨噬细胞的功能表型。免疫组化结果进一步证实,Il4raΔMs4a3 小鼠肺肿瘤中的免疫细胞组成发生显著改变:GMP 来源谱系中 IL-4Rα 的缺失增强了单核细胞和 mo-mac 的免疫原性,将肺肿瘤微环境重新编程为炎症性抗肿瘤状态。
为明确 IL-4 信号发挥作用的具体阶段,研究人员构建了下游细胞特异性缺失模型:将 Il4ra-floxed 小鼠与 Cx3cr1-cre 或 S100a8-cre 小鼠杂交(这两种 Cre 分别在 GMP 下游更成熟的单核细胞和中性粒细胞中表达)。实验结果显示,这两种模型小鼠的肺肿瘤负荷均未出现明显减少,表明 IL-4 信号主要在骨髓祖细胞阶段而非成熟髓系细胞阶段发挥调控作用。
进一步研究揭示了 IL-4 调控肿瘤进展的完整通路:肿瘤微环境产生的可溶性成分通过外周循环到达骨髓,作用于骨髓中的 2 型粒细胞(嗜碱性粒细胞),诱导其产生 IL-4;IL-4 通过结合粒 - 单核细胞祖细胞表面的 IL-4Rα,促进其向免疫抑制性单核细胞和 mo-mac 分化;这些细胞迁移至肿瘤微环境后,通过抑制效应 T 细胞功能促进肿瘤生长。这一发现阐明了肿瘤通过 “远程调控” 骨髓造血过程实现免疫逃逸的全新机制。

五、总结与展望
该研究系统揭示了 IL-4 通过调控骨髓粒 - 单核细胞祖细胞分化、促进免疫抑制性髓系细胞生成,最终导致肿瘤免疫逃逸的分子机制。这些发现不仅加深了我们对肿瘤 - 骨髓轴相互作用的理解,还为肿瘤免疫治疗提供了新的潜在靶点。通过阻断 IL-4 信号通路,可特异性抑制免疫抑制性髓系细胞的生成,重塑肿瘤微环境的免疫状态,增强抗肿瘤免疫应答。
未来研究需进一步探索 IL-4 与其他免疫检查点分子的协同作用,评估 IL-4 中和抗体与 PD-1/PD-L1 抑制剂联合应用的治疗效果。同时,明确肿瘤微环境中诱导嗜碱性粒细胞产生 IL-4 的具体可溶性因子,可为开发更精准的靶向治疗策略提供依据。随着对 IL-4 调控网络研究的深入,有望为克服肿瘤免疫逃逸、提高免疫治疗响应率开辟新的途径。
声明:本篇文章在创作中部分采用了人工智能辅助。如有任何内容涉及版权或知识产权问题,敬请告知,我们承诺将在第一时间核实并撤下。
买重组蛋白,找南京优爱
优爱蛋白专注于提供药物研发、细胞治疗、基因治疗、基础科研所需各种蛋白类试剂原材料和服务,包括药物靶点蛋白、免疫检查点蛋白、细胞因子、工具酶、 蛋白定制表达、全长跨膜蛋白开发等。优爱致力于为客户提供优质的产品和专业服务,打造具有国际竞争力的高新技术企业。
靶点蛋白 | 膜蛋白 | 细胞因子 | 酶 | 病毒抗原 | 蛋白定制
南京优爱生物科技研发有限公司 邮箱:order@ua-bio.com 热线:0571-87565022

产品信息
©2021-2026 南京优爱生物科技研发有限公司版权所有
网站备案号 浙ICP备2022019033号-2 浙公网安备33010202004867号
电话:0571-87565022
邮箱:order@starter-bio.com
本网站销售的所有产品均不得用于人类或动物之临床诊断或治疗,仅可用于工业或者科研等非医疗目的。












