- 最新进展
- 产品信息
最新进展
一、KRAS 突变的肿瘤分布特征与临床意义
KRAS 基因作为 RAS 家族的重要成员,其突变在人类恶性肿瘤中具有极高的发生率和临床相关性,已成为肿瘤研究领域的核心关注点之一。在多种常见恶性肿瘤中,KRAS 突变均呈现出显著的高频特征:胰腺癌作为恶性程度最高的肿瘤之一,其 KRAS 突变率高达 90% 以上,是胰腺癌发生发展的核心驱动事件;非小细胞肺癌中 KRAS 突变率约为 15%-25%,尤其在肺腺癌亚型中更为常见;结直肠癌患者中 KRAS 突变的发生率约为 30%-40%,对治疗策略选择和预后评估具有重要指导价值。此外,在胆管癌、子宫内膜癌等其他恶性肿瘤中,KRAS 突变也占有一定比例,展现出广泛的肿瘤谱分布特征。
从临床预后角度来看,KRAS 突变状态已被明确证实是影响肿瘤患者生存结局的重要不良预后因素。大量临床研究数据表明,携带 KRAS 突变的肿瘤患者往往对传统治疗手段反应不佳,疾病进展速度更快,生存期显著缩短。在肺癌领域,KRAS 突变患者对表皮生长因子受体(EGFR)酪氨酸激酶抑制剂等靶向药物原发性耐药,化疗有效率较野生型患者降低约 20%-30%,中位生存期缩短 3-6 个月;在结直肠癌中,KRAS 突变患者无法从抗 EGFR 单克隆抗体治疗中获益,且术后复发风险增加,5 年生存率较野生型患者降低 15%-20%。这种不良预后特征使得 KRAS 突变肿瘤成为临床治疗的难点和重点。
二、KRAS 的分子生物学功能与突变致癌机制
在正常生理状态下,KRAS 蛋白作为一种重要的分子开关,在细胞信号传导通路中发挥关键调控作用。它通过结合鸟苷三磷酸(GTP)和鸟苷二磷酸(GDP)的构象变化,精准调控下游信号通路的激活与关闭:当 KRAS 与 GTP 结合时处于激活状态,能够启动下游信号传导;而当 GTP 水解为 GDP 时则转为失活状态,终止信号传递。这种动态平衡机制确保了细胞增殖、分化、存活等生理过程的精确调控。
KRAS 突变通过打破这种生理平衡引发恶性转化,其中最常见的突变位点为第 12、13 和 61 位密码子,尤以 G12D、G12V、G12C 等突变亚型最为多见。这些突变导致 KRAS 蛋白构象异常,使其持续处于 GTP 结合的激活状态,丧失了内在的 GTP 酶活性,无法被正常调控机制灭活。持续激活的 KRAS 会异常激活下游多条信号通路,形成复杂的信号网络级联反应:通过激活 BRAF-MEK-ERK 通路显著促进细胞增殖和分化异常;经 PI3K-AKT-mTOR 通路增强细胞存活能力和代谢重编程;通过 RalGDS-Ral 通路影响细胞骨架重塑和侵袭转移能力。这些下游效应共同导致肿瘤细胞获得无限增殖、凋亡抵抗、血管生成、侵袭转移等恶性生物学表型,成为肿瘤进展的核心驱动力量。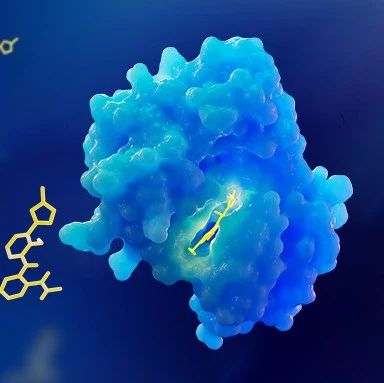

三、KRAS 靶向治疗的研发挑战与历史困境
尽管 KRAS 突变在肿瘤中的重要性早已明确,但针对 KRAS 的靶向药物研发长期面临严峻挑战,成为肿瘤治疗领域的 "硬骨头"。这种困境主要源于 KRAS 蛋白独特的分子结构特征:KRAS 蛋白分子量小(约 21kDa),表面相对光滑,缺乏传统小分子药物可结合的深口袋状活性位点,难以设计高特异性的结合配体;其与 GTP 的结合具有极高的亲和力(解离常数达皮摩尔级别),外源性小分子难以竞争结合;同时,KRAS 在细胞内表达水平高且周转迅速,进一步增加了药物有效抑制的难度。
相比之下,同家族的 EGFR 等靶点的靶向药物研发则进展顺利,目前 EGFR 抑制剂已发展至第四代,形成了完整的临床应用体系。而 KRAS 靶向药物的研发长期处于停滞状态,在很长一段时间内,"不可成药" 成为 KRAS 研究领域的普遍认知。早期研发尝试主要集中于间接抑制策略,如针对下游 BRAF、MEK 等靶点的抑制剂,但临床实践表明,这些单药治疗在 KRAS 突变肿瘤中往往效果有限,易出现快速耐药。其原因在于 KRAS 上游信号的持续激活可通过旁路途径重新激活下游通路,导致治疗失败,这也凸显了直接靶向 KRAS 的必要性和紧迫性。
四、免疫治疗在 KRAS 突变肿瘤中的应用进展
在靶向治疗陷入困境的背景下,免疫治疗的兴起为 KRAS 突变肿瘤患者带来了新的治疗希望。免疫治疗通过调节机体免疫系统功能,增强抗肿瘤免疫应答,与靶向治疗的作用机制截然不同,为 KRAS 突变这类难治性肿瘤提供了全新的治疗思路。
在非小细胞肺癌领域,多项临床研究探讨了免疫检查点抑制剂在 KRAS 突变患者中的疗效。PD-1 抗体 Opdivo(纳武利尤单抗)的临床试验数据显示,在 KRAS 突变、有吸烟史且 EGFR 野生型的非小细胞肺癌患者中,免疫治疗的客观缓解率和无进展生存期均显著优于传统化疗,提示这部分患者可能从免疫治疗中获得更大获益。进一步研究发现,KRAS 突变肿瘤可能通过多种机制影响免疫微环境:突变导致的代谢异常可能改变肿瘤微环境中的细胞因子谱;异常信号通路激活可能上调肿瘤细胞表面 PD-L1 等免疫抑制分子的表达,为免疫检查点抑制剂的应用提供了理论基础。
在结直肠癌领域,免疫治疗的应用呈现出更复杂的局面。结直肠癌患者可分为微卫星不稳定型(MSI-H)和微卫星稳定型(MSS),其中 MSI-H 患者对 PD-1/PD-L1 抑制剂敏感性高,而占绝大多数的 MSS 患者单独使用免疫检查点抑制剂疗效不佳。KRAS 突变在 MSS 结直肠癌中更为常见,进一步增加了治疗难度。2016 年美国临床肿瘤学会(ASCO)年会上公布的一项 Ⅰ 期临床试验结果显示,PD-L1 抗体 Tecentriq(阿替利珠单抗)联合 MEK 抑制剂 Cobimetinib 治疗 MSS/KRAS 突变结直肠癌患者时,取得了一定的临床获益:在入组的 23 例 MSS 结直肠癌患者中(其中 22 例存在 KRAS 突变),4 例患者达到部分缓解(肿瘤缩小≥30%),5 例患者实现疾病稳定,总体疾病控制率达到 40%。这一研究证实了免疫治疗联合下游通路抑制在 KRAS 突变肿瘤中的协同潜力,为联合治疗策略提供了重要依据。

五、TCR-T 细胞治疗在 KRAS 突变肿瘤中的应用前景
随着细胞治疗技术的快速发展,T 细胞受体工程化 T 细胞(TCR-T)技术为 KRAS 突变肿瘤的治疗开辟了新的研究方向。TCR-T 技术通过基因工程手段,将识别肿瘤特异性抗原的 T 细胞受体(TCR)导入患者自体 T 细胞中,增强 T 细胞对肿瘤细胞的识别和杀伤能力。与 CAR-T 技术相比,TCR-T 能够识别细胞内抗原经主要组织相容性复合体(MHC)呈递的肽段,理论上可靶向更多类型的肿瘤抗原,包括 KRAS 等胞内突变抗原,展现出独特的优势。
目前,针对 KRAS 突变的 TCR-T 细胞治疗研究已进入临床前和早期临床探索阶段。Kite Pharma 等研究机构开展的 TCR-T 疗法针对 KRAS G12D 等常见突变亚型,该突变在胰腺癌、结直肠癌和肺癌中均有较高发生率。值得注意的是,TCR-T 治疗的有效性高度依赖于抗原肽与患者 MHC 分子的结合,因此在临床应用中需要对患者进行 HLA 分型检测。初步研究表明,HLA-A11 基因型的患者可能更适合接受针对 KRAS G12D 突变的 TCR-T 治疗,这为精准筛选获益人群提供了重要参考。
临床前研究显示,靶向 KRAS 突变的 TCR-T 细胞在体外和动物模型中均能特异性识别并杀伤携带相应突变的肿瘤细胞,显著抑制肿瘤生长。目前,针对 KRAS 突变的 TCR-T 临床试验正在逐步开展,主要纳入胰腺癌、结直肠癌和肺癌等 KRAS 突变高发的肿瘤类型,重点评估其安全性和初步疗效。这些研究设计涵盖了不同的 KRAS 突变亚型、HLA 匹配条件和治疗方案,旨在探索 TCR-T 技术在 KRAS 突变肿瘤中的最佳应用模式。
六、KRAS 突变肿瘤治疗的未来展望
近年来,KRAS 靶向治疗领域终于迎来突破性进展,以 KRAS G12C 抑制剂为代表的新型药物成功上市,打破了 KRAS"不可成药" 的僵局。这些抑制剂通过与 KRAS G12C 突变体的半胱氨酸残基特异性结合,将其锁定在失活状态,在临床试验中展现出显著的抗肿瘤活性,为部分 KRAS G12C 突变患者带来了治疗希望。然而,对于 G12D、G12V 等其他常见突变亚型,有效的靶向药物仍有待研发,联合治疗策略也成为提高疗效的重要方向,如 KRAS 抑制剂与 MEK 抑制剂、免疫检查点抑制剂的联合应用正在积极探索中。
同时,TCR-T 等细胞治疗技术的发展为 KRAS 突变肿瘤提供了多元化的治疗选择。随着 TCR 筛选技术的优化、基因编辑效率的提高和细胞制备工艺的改进,TCR-T 治疗的安全性和有效性将不断提升。未来研究需要进一步明确 KRAS 突变肽的免疫原性特征,优化 TCR 的亲和力和特异性,降低脱靶效应和细胞因子释放综合征等不良反应风险。
在精准医疗理念的指导下,基于 KRAS 突变亚型、伴随突变谱、免疫微环境特征和 HLA 基因型的个体化治疗策略将成为发展趋势。通过多组学检测技术,全面解析患者的分子特征,实现治疗方案的精准匹配,有望进一步提高 KRAS 突变肿瘤的治疗效果。此外,KRAS 突变作为肿瘤早期诊断和预后评估的生物标志物价值也在不断挖掘,将为肿瘤的早筛早诊和全程管理提供重要支撑。
总体而言,KRAS 突变肿瘤的治疗已从长期困境逐步走向多元化发展的新阶段,随着基础研究的深入和技术创新的推动,未来必将有更多更有效的治疗策略问世,为 KRAS 突变肿瘤患者带来新的生存希望。

声明:本篇文章在创作中部分采用了人工智能辅助。如有任何内容涉及版权或知识产权问题,敬请告知,我们承诺将在第一时间核实并撤下。
买重组蛋白,找南京优爱
优爱蛋白专注于提供药物研发、细胞治疗、基因治疗、基础科研所需各种蛋白类试剂原材料和服务,包括药物靶点蛋白、免疫检查点蛋白、细胞因子、工具酶、 蛋白定制表达、全长跨膜蛋白开发等。优爱致力于为客户提供优质的产品和专业服务,打造具有国际竞争力的高新技术企业。
靶点蛋白 | 膜蛋白 | 细胞因子 | 酶 | 病毒抗原 | 蛋白定制
南京优爱生物科技研发有限公司 邮箱:order@ua-bio.com 热线:0571-87565022

产品信息
©2021-2026 南京优爱生物科技研发有限公司版权所有
网站备案号 浙ICP备2022019033号-2 浙公网安备33010202004867号
电话:0571-87565022
邮箱:order@starter-bio.com
本网站销售的所有产品均不得用于人类或动物之临床诊断或治疗,仅可用于工业或者科研等非医疗目的。












