- 最新进展
- 产品信息
最新进展
Sonic Hedgehog(SHH)信号通路作为胚胎发育中的关键调控网络,其异常激活与多种恶性肿瘤的发生密切相关,其中 SHH 型髓母细胞瘤(MBSHH)是该通路异常驱动的典型代表。近年来,针对 SHH 通路的靶向药物研发为 MBSHH 的治疗提供了新方向,尤其是 SMO 抑制剂 Vismodegib 的临床应用研究,揭示了分子分型指导下精准治疗的潜力。本文系统阐述 SHH 信号通路的分子机制、其在 MBSHH 中的异常特征,以及靶向治疗的临床研究进展与挑战。
一、SHH 信号通路的分子机制与生物学功能
SHH 信号通路通过严密的分子级联反应调控细胞增殖、分化及组织极性,其生理功能的精准实现依赖于各组分的协同作用。
(一)核心信号传导机制
SHH 通路的激活遵循 “配体 - 受体 - 效应因子” 的层级调控模式。分泌型蛋白 SHH 与细胞膜上的跨膜受体 PTCH1(Patched 1)结合,解除 PTCH1 对下游信号分子 SMO(Smoothened)的抑制。SMO 从细胞质转移至初级纤毛膜,通过构象变化激活下游信号复合体,解除 SUFU(Suppressor of Fused)对 GLI 家族转录因子(GLI1、GLI2)的束缚。游离的 GLI 进入细胞核,启动靶基因(如 PTCH1、GLI1、MYCN 等)的表达,形成负反馈调节环路,维持通路活性的动态平衡。
在胚胎发育阶段,SHH 通路参与神经系统、骨骼系统的形态发生,尤其在小脑发育中起关键作用;成年后通路多处于静息状态,其异常激活则可能诱发肿瘤。
(二)MBSHH 中的通路异常特征
SHH 型髓母细胞瘤是髓母细胞瘤的主要亚型之一,约占所有病例的 30%,好发于婴幼儿(<3 岁)和青少年(>16 岁),其分子特征与 SHH 通路的遗传学异常密切相关。约 50% 的 MBSHH 存在 PTCH1 的失活突变(体细胞或种系突变),导致对 SMO 的抑制解除;SUFU 突变(约 10%)则通过增强对 GLI 的抑制失效,直接激活通路。SMO 的激活突变(如 D473H)可模拟配体结合状态,持续传递信号。GLI1/GLI2 扩增或 MYCN 扩增(约 15%)可绕过上游调控,直接驱动靶基因表达,导致肿瘤细胞恶性增殖。
这些遗传学异常共同导致 SHH 通路的持续激活,成为 MBSHH 发生发展的核心驱动因素。
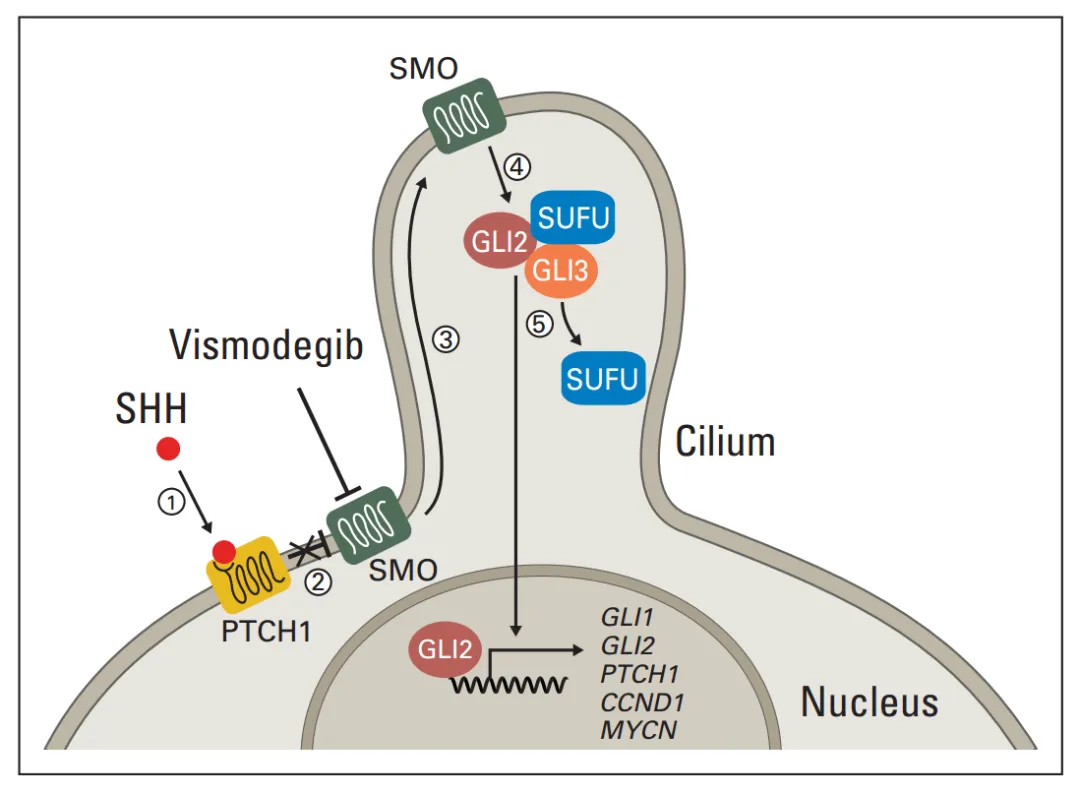
SHH信号通路简图。①SHH与跨膜蛋白PTCH1结合;②解除对SMO的抑制;③SMO定位于细胞纤毛;④SMO解除SUFU对GLI的抑制;⑤GLI进入细胞核激活下游靶基因。
二、Vismodegib 靶向治疗 MBSHH 的临床研究
Vismodegib 作为首个获批的 SMO 选择性抑制剂,通过竞争性结合 SMO 的跨膜结构域,阻断其构象激活,从而抑制 SHH 通路下游信号。针对复发 MBSHH 的临床研究(PBTC-025B 与 PBTC-032)为其疗效与安全性提供了关键证据。
(一)研究设计与患者特征
两项研究均基于 1 期临床试验(PBTC-025)确定的剂量方案(150mg/d,体表面积 0.67~1.32m²;300mg/d,体表面积 1.33~2.5m²),纳入复发或难治性髓母细胞瘤患者。PBTC-025B 共入组 31 例患者,经分子分型确认 20 例为 MBSHH,9 例为非 SHH 型;PBTC-032 仅纳入 9 例 MBSHH 患者(前期研究显示非 SHH 型无应答)。
疗效评价中,客观缓解率(ORR)定义为完全缓解(CR)或部分缓解(PR)持续≥8 周,其中 PBTC-025B 采用 RECIST 标准(PR:肿瘤缩小≥30%),PBTC-032 采用更严格标准(PR:肿瘤缩小≥50%)。分子生物学分析通过福尔马林固定石蜡包埋(FFPE)样本,检测 PTCH1、GLI2、MYCN 等基因的拷贝数变异,结合免疫组化(IHC)分析 p53 表达,并对 8 例患者的肿瘤组织进行全外显子测序。
(二)临床疗效与安全性
研究结果显示,Vismodegib 对复发 MBSHH 具有一定治疗价值,且呈现年龄与分子背景的差异性。3 例成人患者与 1 例儿童患者达到客观缓解,5 例成人与 3 例儿童出现短暂影像学缓解(未维持至下一评估点)。MBSHH 患者的无进展生存期(PFS)显著长于非 SHH 型患者(尤其成人亚组),提示疗效与亚型特异性相关。
药物耐受性良好,未出现因不良反应导致的停药,儿童患者未观察到骨骼发育异常或口腔黏膜炎(常见于成人基底细胞癌治疗的不良反应)。这些结果证实,Vismodegib 可延长复发 MBSHH 患者的疾病控制时间,且安全性可控。
(三)分子标志物与疗效预测
遗传学特征分析揭示了 Vismodegib 疗效的预测因子,为精准治疗提供依据。PTCH1 缺失的患者 PFS 显著延长,提示上游通路异常(SMO 上游)的肿瘤对 SMO 抑制剂更敏感。p53 弥漫阳性(提示 TP53 突变)与较短 PFS 相关,6 例 p53 阳性患者中 4 例伴随 GLI2 或 MYCN 扩增,可能通过非依赖 SMO 的途径驱动肿瘤;SUFU 突变或 GLI2 扩增的患者(8 例测序中 4 例)均未出现客观缓解,表明下游通路异常可导致耐药。
2例耐药患者同时存在 PI3K 通路突变,提示 SHH 与 PI3K 通路的交叉激活可能加剧耐药。这些发现表明,MBSHH 的分子亚型是预测 Vismodegib 疗效的关键因素,上游突变患者更可能受益。
三、SHH 靶向治疗的挑战与未来方向
尽管 Vismodegib 为 MBSHH 治疗带来突破,但其临床应用仍面临诸多挑战,推动着靶向策略的优化与创新。
(一)耐药机制与应对策略
临床研究显示,多数患者的缓解持续时间较短(中位约 6 个月),耐药机制主要包括:原发性耐药(下游分子异常如 GLI2 扩增、SUFU 突变导致通路激活不依赖 SMO);获得性耐药(SMO 的二次突变或通路重塑如 IL6/STAT3 通路激活可绕过 SMO 抑制);肿瘤微环境(肿瘤相关成纤维细胞分泌的 SHH 配体可能维持通路活性,削弱药物作用)。
应对策略包括:开发新一代 SMO 抑制剂(如 Sonidegib)以克服突变耐药;联合 GLI 抑制剂(如 GANT61)直接靶向下游效应因子;双靶点抑制(如 SHH+PI3K)阻断协同通路。
(二)分子分型指导的精准治疗
研究证实,完整的遗传学检测(如 PTCH1、SUFU、GLI2、TP53 等)是筛选获益人群的前提。对 PTCH1 突变或 SMO 突变患者,SMO 抑制剂仍为首选;对 SUFU 突变或 GLI 扩增患者,应考虑下游靶向或联合治疗;种系突变患者(如 Gorlin 综合征相关 MBSHH)需长期监测,预防多原发肿瘤。
结合液体活检技术动态监测循环肿瘤 DNA(ctDNA)中的突变谱,可实时评估疗效与耐药,指导治疗调整。
(三)儿童患者的治疗优化
儿童 MBSHH 的治疗面临特殊挑战。年龄相关差异方面,研究中儿童客观缓解率低于成人,可能与更频繁的下游突变(如 SUFU 种系突变)相关。长期安全性上,SMO 抑制剂可能影响儿童骨骼发育,需平衡疗效与生长发育需求。联合治疗探索中,与化疗(如卡铂)或放疗的协同效应正在临床试验中评估,以期提高缓解深度与持续时间。
结语
SHH 信号通路的异常激活是 MBSHH 发生的核心机制,SMO 抑制剂 Vismodegib 的临床研究证实了靶向该通路的可行性,尤其对上游突变的成人患者显示出明确疗效。分子标志物的发现为精准筛选获益人群提供了依据,而耐药机制的解析则推动着联合治疗策略的发展。未来,随着对 SHH 通路调控网络理解的深入,结合多组学检测与新型靶向药物的研发,有望进一步提升 MBSHH 的治疗效果,为患者带来长期生存获益。
声明:本篇文章在创作中部分采用了人工智能辅助。如有任何内容涉及版权或知识产权问题,敬请告知,我们承诺将在第一时间核实并撤下。
买重组蛋白,找南京优爱
优爱蛋白专注于提供药物研发、细胞治疗、基因治疗、基础科研所需各种蛋白类试剂原材料和服务,包括药物靶点蛋白、免疫检查点蛋白、细胞因子、工具酶、 蛋白定制表达、全长跨膜蛋白开发等。优爱致力于为客户提供优质的产品和专业服务,打造具有国际竞争力的高新技术企业。
靶点蛋白 | 膜蛋白 | 细胞因子 | 酶 | 病毒抗原 | 蛋白定制
南京优爱生物科技研发有限公司 邮箱:order@ua-bio.com 热线:0571-87565022

产品信息
©2021-2026 南京优爱生物科技研发有限公司版权所有
网站备案号 浙ICP备2022019033号-2 浙公网安备33010202004867号
电话:0571-87565022
邮箱:order@starter-bio.com
本网站销售的所有产品均不得用于人类或动物之临床诊断或治疗,仅可用于工业或者科研等非医疗目的。












