- 最新进展
- 产品信息
最新进展
一、Siglec 家族与 Siglec-3 的分子特征
唾液酸结合免疫球蛋白样凝集素(Siglec)家族是一类识别含唾液酸聚糖的跨膜受体,在肿瘤微环境免疫抑制中起重要作用。该家族含 15 种人源和 9 种鼠源分子,按进化保守性分为序列保守型和 CD33 相关快速进化型。Siglec-3(CD33)属 CD33 相关亚家族,是肿瘤免疫研究的焦点之一。
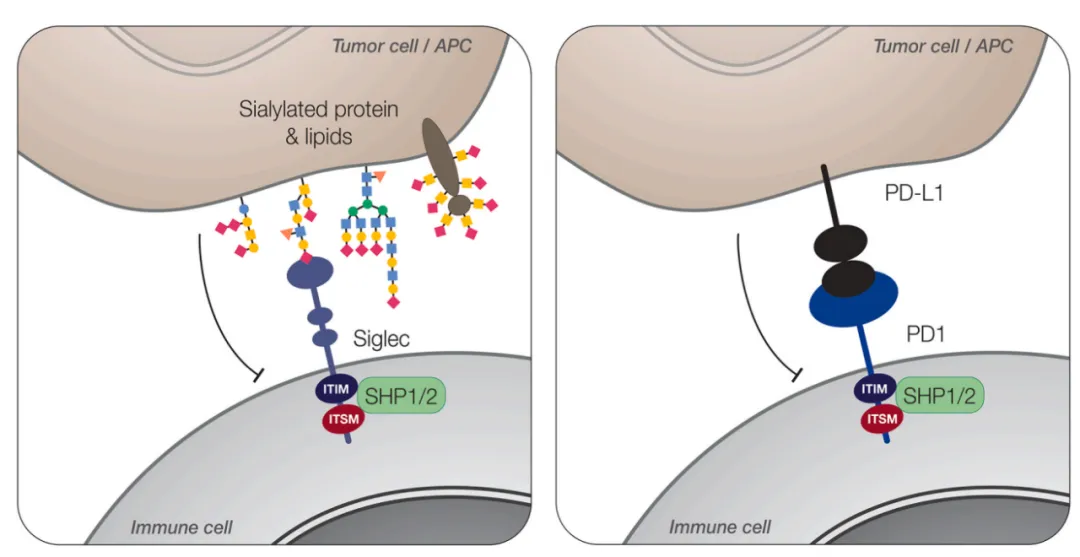
Siglec-3 为 Ⅰ 型膜蛋白,具有典型 Siglec 结构:胞外区含 1 个唾液酸结合的 V-set 免疫球蛋白结构域和 1 个 C2-set 免疫球蛋白结构域,跨膜区有带正电荷氨基酸残基,胞内区含 2 个免疫受体酪氨酸抑制基序(ITIM)。当与含唾液酸配体结合,胞内 ITIM 酪氨酸磷酸化,招募 SHP1、SHP2 等磷酸酶,抑制下游免疫激活信号,类似 PD-1 的负向调节机制。
与 Siglec-7、Siglec-9 等抑制性成员相比,Siglec-3 表达具细胞谱系特异性,主要在髓系细胞(单核细胞、巨噬细胞、树突状细胞)表面,中性粒细胞和 NK 细胞中表达低,这决定了其在髓系免疫细胞功能调控中的核心地位。
二、Siglec-3 的配体及其在肿瘤微环境中的表达特征
Siglec-3 功能依赖与含唾液酸聚糖配体的结合。肿瘤细胞及基质细胞常异常高唾液酸化,产生大量其配体,形成 “唾液酸聚糖 - Siglec-3” 轴,参与肿瘤免疫逃逸。
肿瘤细胞高唾液酸化由唾液酸转移酶(ST3GAL1、ST3GAL4、ST6GAL1 等)异常表达驱动。急性髓系白血病(AML)中,白血病细胞表面 CD166、CD43 等高唾液酸化,成为主要配体;胰腺癌、结直肠癌等实体瘤中,肿瘤细胞分泌的黏液蛋白(MUC1、MUC16)经唾液酸修饰后,可与肿瘤浸润巨噬细胞表面 Siglec-3 结合。此外,肿瘤相关成纤维细胞分泌的唾液酸化透明质酸,也可作为配体参与免疫抑制。
临床研究显示,肿瘤组织中 Siglec-3 配体表达水平与患者预后相关。AML 患者中,高表达唾液酸化配体者髓系抑制细胞浸润多,对化疗和免疫治疗响应率低;乳腺癌模型中,肿瘤细胞表面高表达其配体可抑制巨噬细胞吞噬,促进转移。这表明 “唾液酸聚糖 - Siglec-3” 轴激活是肿瘤免疫逃逸的重要机制。
三、Siglec-3 对肿瘤免疫细胞功能的调控作用
Siglec-3 通过与配体作用调控多种免疫细胞功能,塑造免疫抑制性肿瘤微环境:
(一)对巨噬细胞的调控
肿瘤相关巨噬细胞(TAM)是 Siglec-3 主要表达细胞。胰腺癌、卵巢癌等实体瘤中,肿瘤细胞唾液酸化配体与 TAM 表面 Siglec-3 结合,激活 SHP1/2 信号通路,抑制巨噬细胞向促炎表型转化,减少 IL-12、TNF-α 等促炎因子,增加 IL-10、TGF-β 等抗炎因子,同时抑制吞噬功能,减少对肿瘤细胞的清除。此外,还促进 TAM 表达 VEGF,间接促进肿瘤血管生成。
(二)对树突状细胞的影响
树突状细胞(DC)抗原提呈功能是启动适应性抗肿瘤免疫的关键。单核细胞衍生 DC 表面表达 Siglec-3,与肿瘤细胞分泌的唾液酸化配体结合后,成熟受抑,CD80、CD86 等共刺激分子表达降低,IL-23 分泌减少,对 CD4⁺和 CD8⁺T 细胞激活能力下降。肺癌模型中,阻断 Siglec-3 信号可恢复 DC 成熟表型,增强诱导抗肿瘤 T 细胞应答能力。
(三)对急性髓系白血病细胞的自调控
AML 中,白血病细胞自身表达 Siglec-3,形成 “自分泌” 调控环。其分泌的唾液酸化配体与自身 Siglec-3 结合,激活 PI3K/Akt 信号通路促进存活,抑制 Bax 等凋亡相关蛋白表达,增强对化疗药物的耐药性,为 AML 靶向治疗提供独特切入点。
(四)对中性粒细胞的调节
中性粒细胞在肿瘤微环境中可分化为促瘤 N2 型。研究表明,Siglec-3 在中性粒细胞表面表达随肿瘤进展升高,与肿瘤细胞配体结合可抑制其氧化爆发和中性粒细胞胞外陷阱(NETs)形成,削弱杀伤能力。结直肠癌肝转移模型中,阻断 Siglec-3 可恢复中性粒细胞抗肿瘤活性,减少转移灶。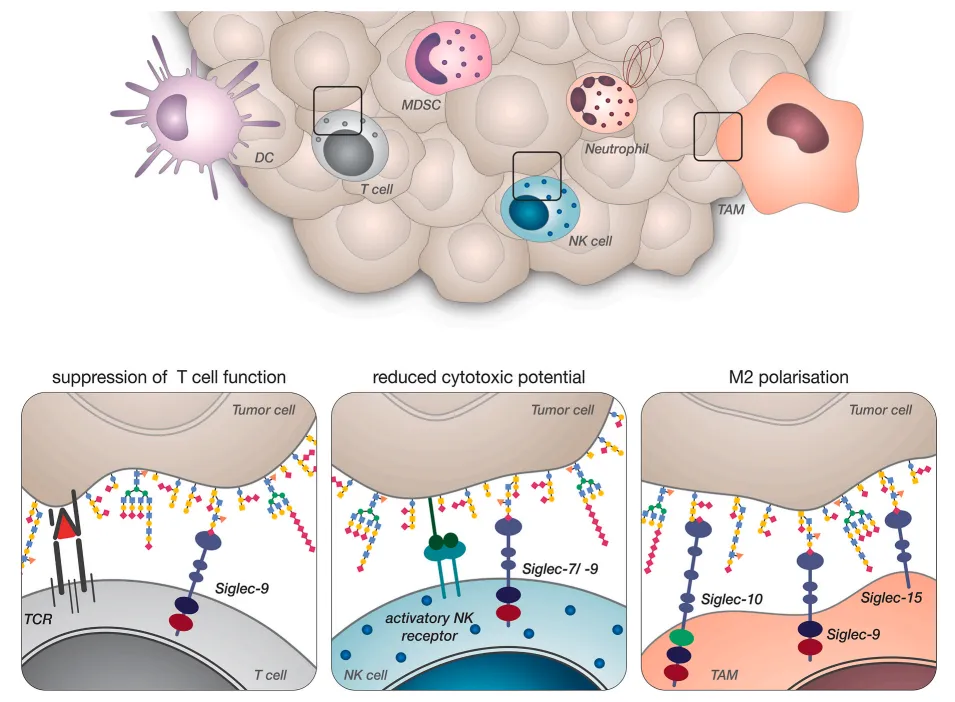

四、靶向 Siglec-3 的肿瘤治疗策略与研究进展
基于 Siglec-3 在肿瘤免疫抑制中的作用,靶向治疗策略成为新方向:
(一)Siglec-3 阻断性抗体
开发特异性阻断其与配体结合的单克隆抗体,可解除免疫抑制。临床前研究显示,抗 Siglec-3 单克隆抗体在 AML 模型中,能阻断白血病细胞与巨噬细胞表面 Siglec-3 的相互作用,促进吞噬;在实体瘤模型中,可使 TAM 向促炎表型极化,增强 CD8⁺T 细胞浸润和杀伤活性。人源化单克隆抗体(如 IMGN632)已进入 Ⅰ 期临床试验,用于治疗复发 / 难治性 AML,安全性和抗肿瘤活性良好。
(二)抗体偶联药物(ADC)
利用 Siglec-3 在 AML 等肿瘤细胞表面的特异性表达,将抗体与细胞毒性载荷偶联,可精准杀伤肿瘤细胞。如抗 Siglec-3 抗体与 DNA 损伤剂结合的 ADC,在 AML 动物模型中可选择性富集于白血病细胞,诱导凋亡,对正常造血干细胞毒性低,已进入临床前评价阶段。
(三)唾液酸代谢抑制剂
抑制肿瘤细胞唾液酸合成或修饰,减少 Siglec-3 配体,可间接阻断 “唾液酸聚糖 - Siglec-3” 轴。唾液酸转移酶抑制剂(如 ST3GAL1 抑制剂)在胰腺癌模型中可降低肿瘤细胞唾液酸化水平,增强巨噬细胞吞噬功能;2 - 脱氧 - D - 葡萄糖等唾液酸合成前体类似物,在 AML 模型中与化疗药物联用可提高疗效。
(四)联合治疗策略
靶向 Siglec-3 与其他免疫检查点抑制剂联用显协同效应。黑色素瘤模型中,抗 Siglec-3 抗体与抗 PD-1 抗体联用,可增加肿瘤浸润 T 细胞数量和活性,抑制肿瘤生长效果优于单一治疗;AML 模型中,Siglec-3 阻断与 CD47 抗体联用,可协同促进巨噬细胞对白血病细胞的吞噬,延长模型动物生存期。
五、总结与展望
Siglec-3 通过识别肿瘤微环境中唾液酸聚糖配体,调控巨噬细胞、树突状细胞等免疫细胞功能,是肿瘤免疫逃逸的重要介质。针对其的靶向治疗策略在临床前研究中显良好抗肿瘤潜力,部分药物进入临床试验,为克服肿瘤对现有免疫治疗的耐药性带来希望。
但 Siglec-3 靶向治疗仍面临挑战:正常髓系细胞表达可能致治疗毒性;其他 Siglec 家族成员代偿性激活可能影响效果;“唾液酸聚糖 - Siglec-3” 轴与其他免疫检查点通路的交叉调控机制需深入解析。未来需优化靶向分子特异性,探索联合治疗方案,结合患者分子分型实现个体化治疗,推动其在肿瘤临床治疗中的应用。
产品信息













