- 最新进展
- 产品信息
最新进展
一、Siglec-7 的分子特征与配体识别基础
唾液酸结合免疫球蛋白样凝集素(Siglecs)家族作为一类依赖聚糖识别的免疫受体,其成员 Siglec-7 因在癌症免疫调节中的潜在价值而备受关注。Siglec-7 属于 CD33 相关快速进化亚家族,是一种 Ⅰ 型跨膜蛋白,胞外区包含 1 个负责唾液酸结合的 V-set 免疫球蛋白结构域和 2 个 C2-set 免疫球蛋白结构域,胞内区则含有典型的免疫受体酪氨酸抑制基序(ITIM)和免疫受体开关基序(ITSM)。当与含唾液酸的配体结合时,这些基序发生磷酸化,招募 SHP1、SHP2 等磷酸酶,进而抑制下游免疫激活信号,这一机制与其他抑制性 Siglec 家族成员类似。
尽管 Siglec-7 的免疫调节作用已得到初步证实,但其生理配体的具体特征长期以来尚未完全明确。近期研究通过基于细胞的基因组筛选及糖组学分析,揭示了 Siglec-7 的配体识别模式:该受体对 O - 连接的四糖结构 “二唾液酸化核心 1(disialyl core 1)” 具有高度特异性,且这种结合依赖于配体所处的蛋白质支架。其中,细胞表面黏蛋白型糖蛋白 CD43 的 N 末端区域因富含相邻排列的二唾液酸核心 1 O - 聚糖簇,成为 Siglec-7 的关键结合靶点。此外,PSGL1、GP1α 等黏蛋白型糖蛋白也被证实可作为 Siglec-7 的配体,但其亲和力与结合效率均低于 CD43,表明配体的蛋白质骨架结构对 Siglec-7 的识别效率具有重要影响。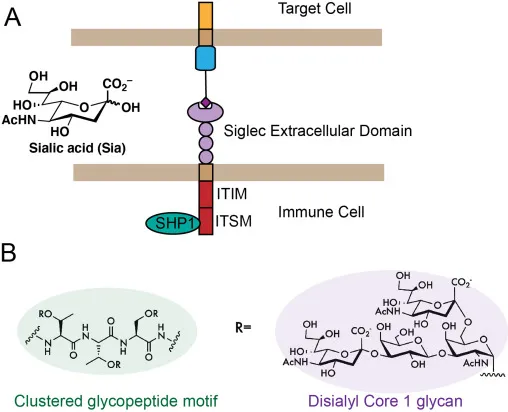

图1:A)Siglec免疫受体与聚糖配体结合。然后通过细胞内ITIM/ITSM结构域转导信号。B)Siglec-7结合基序的化学结构。
二、Siglec-7 配体在外周免疫细胞中的表达特征
为明确 Siglec-7 配体的细胞分布规律,研究者对人类外周血单核细胞(PBMCs)中的不同免疫亚群进行了系统分析。通过重组 Siglec-7-Fc 蛋白染色结合流式细胞术检测发现,Siglec-7 配体在 CD3⁺T 细胞表面呈高水平均匀表达,而在 CD3⁻细胞(如 CD14⁺单核细胞、CD19⁺B 细胞)中仅表现出微弱且部分阳性的染色信号。这一结果提示,外周 T 细胞是 Siglec-7 配体的主要表达细胞。
进一步的亚群分析显示,Siglec-7 配体的表达具有 T 细胞亚群特异性:在 CD4⁺T 细胞中,初始型(CD45RO⁻)细胞的配体表达水平显著高于记忆型(CD45RO⁺)细胞;在 CD4⁺记忆 T 细胞的功能亚群中,TH1(CXCR3⁺)细胞的配体表达量高于 TH2(CCR4⁺CCR6⁻)和 TH17(CCR4⁺CCR6⁺)细胞。值得注意的是,T 细胞活化状态可动态调控 Siglec-7 配体的表达 —— 经 CD3/CD28 抗体及 IL-2 刺激 5 天后,T 细胞表面的 Siglec-7 配体水平显著降低,而相关受体 Siglec-9 的配体表达却明显增加,这表明 Siglec 配体的生物合成受细胞活化状态的选择性调控,而非唾液酸表达的整体变化。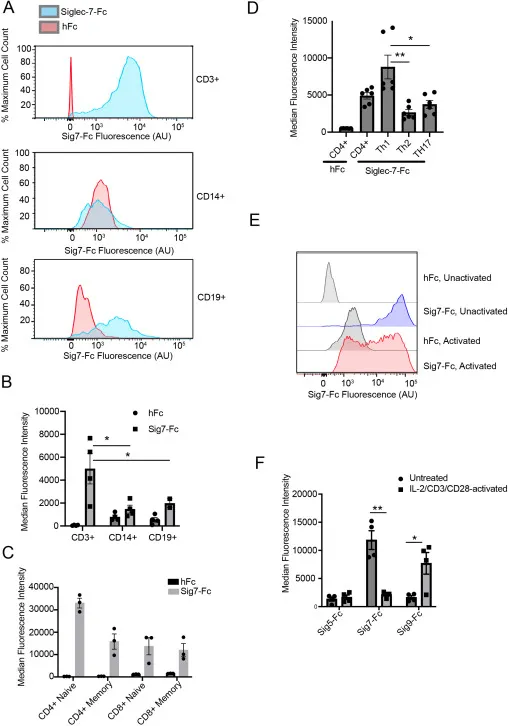

图2:具有代表性的流式细胞术结果以及不同供体的平均中值荧光强度(MFI)
三、Siglec-7 配体的分子本质与调控机制
为阐明 Siglec-7 配体的分子类型,研究者采用聚糖降解酶处理结合蛋白质组学分析的策略,证实外周免疫细胞上的 Siglec-7 配体主要为 O - 连接糖蛋白,而非 N - 连接糖蛋白。具体而言,用 O - 糖蛋白酶 StcE 处理 PBMCs 后,Siglec-7-Fc 的结合能力显著下降,其效应与唾液酸酶处理相当;而 N - 糖蛋白酶 PNGase F 处理对结合无明显影响,明确了 O - 连接聚糖在 Siglec-7 识别中的核心作用。
通过 Siglec-7-Fc 蛋白下拉结合质谱分析,CD43 被鉴定为 PBMCs 中与 Siglec-7 结合能力最强的配体,其富集度是其他候选蛋白的 50 倍以上。进一步研究发现,T 细胞表达的 CD43 呈现 125 kDa 的特异性糖型,该糖型富含二唾液酸核心 1 O - 聚糖;而单核细胞表达的 CD43 则以 150 kDa 糖型为主,其聚糖结构多为唾液酸化核心 2,无法与 Siglec-7 有效结合。糖组学分析证实,二唾液酸核心 1 结构是 T 细胞表面最丰富的 O - 聚糖类型,占总 O - 聚糖结构的 60% 以上,这为 Siglec-7 与 T 细胞的特异性相互作用提供了结构基础。
Siglec-7 配体的细胞特异性表达主要受糖基转移酶 GCNT1 的调控。GCNT1 可催化核心 1 O - 聚糖向核心 2 结构转化,而核心 2 结构无法被 Siglec-7 识别。在初始 T 细胞中,GCNT1 的 mRNA 表达水平显著低于单核细胞和 B 细胞,导致其核心 1 O - 聚糖积累,从而高表达 Siglec-7 配体;反之,单核细胞因高表达 GCNT1,核心 2 O - 聚糖占比增加,Siglec-7 配体表达降低。实验证实,敲低单核细胞系 THP-1 中的 GCNT1 可显著增加 Siglec-7 配体表达,并使 CD43 糖型从 150 kDa 向 125 kDa 转变,进一步验证了 GCNT1 作为分子开关对 Siglec-7 配体合成的调控作用。
四、Siglec-7 对 T 细胞功能的调节作用及机制
鉴于抗原呈递细胞(如树突状细胞、巨噬细胞)高表达 Siglec-7,而 T 细胞高表达其配体,研究者推测 Siglec-7 可能通过细胞间相互作用调控 T 细胞活化。混合白细胞反应(MLR)模型显示,用 Siglec-7 阻断抗体处理共培养体系后,DCs 与 T 细胞的相互作用增强,导致 IL-6、IFN-γ 等细胞因子的分泌量显著增加,提示 Siglec-7 与其配体的结合可抑制 T 细胞的活化信号。
更具创新性的发现是,Siglec-7 可直接调控 T 细胞功能。体外实验显示,将可溶性 Siglec-7-Fc 蛋白与抗 CD3/CD28 抗体共刺激原代 T 细胞,可显著抑制 T 细胞增殖(CFSE 稀释率降低 40%),并改变细胞因子分泌谱 ——IL-2 分泌减少 35%,而 TH2 型细胞因子 IL-4 分泌增加 2.5 倍,表明 Siglec-7 不仅抑制 T 细胞活化,还可能促进其向 TH2 表型极化。这一现象与传统认知中 Siglec-7 仅作为抑制性受体的功能不同,提示其可能通过直接激活 T 细胞内的信号通路发挥作用,这一机制类似于半乳糖凝集素通过糖蛋白聚集触发 T 细胞信号的模式,为理解 Siglec 家族的多功能性提供了新视角。
五、研究意义与展望
本研究系统阐明了 Siglec-7 配体的分子特征、表达调控机制及其对 T 细胞功能的调节作用,首次证实了 Siglec-7 介导的新型信号轴的存在 —— 该轴通过 “抗原呈递细胞 Siglec-7-T 细胞配体” 的相互作用,在生理状态下抑制 T 细胞过度活化,并参与其表型极化。这一发现突破了 Siglec 家族仅通过抑制性信号调控先天免疫的传统认知,揭示了其在适应性免疫调节中的新功能。
从应用价值来看,这些发现为靶向 Siglec-7 的免疫治疗提供了理论基础。在癌症治疗中,阻断 Siglec-7 可能解除其对 T 细胞的抑制,增强抗肿瘤免疫应答;而在自身免疫病中,激活 Siglec-7 信号或可抑制过度活跃的 T 细胞,缓解炎症反应。未来研究需进一步解析 Siglec-7 在 T 细胞中触发的具体信号通路,明确其与 TCR 信号的交叉调控机制,并探索其在不同疾病模型中的治疗潜力,以推动 Siglec-7 靶向疗法的开发与应用。
产品信息













