肿瘤细胞通过多种机制逃避免疫系统监视,其中免疫微环境的重塑是关键环节。传统研究认为,肿瘤主要通过分泌趋化因子、TGFβ 等非接触方式驯化免疫细胞。2016 年《Nature Immunology》发表的研究揭示了一种新的接触性驯化机制:肿瘤细胞表面粘蛋白 MUC1 的异常唾液酸化糖基可通过结合免疫细胞表面的 Siglec-9,实现对单核 / 巨噬细胞的功能调控。
Siglec 家族(唾液酸结合免疫球蛋白样凝集素)作为免疫细胞表面的糖蛋白受体,通过识别唾液酸化糖基参与免疫调节。Siglec-9 主要表达于单核细胞、巨噬细胞等免疫细胞表面,其在肿瘤免疫中的作用此前尚未明确。该研究聚焦 MUC1 异常糖基化与 Siglec-9 的相互作用,为理解肿瘤免疫逃逸提供了新视角。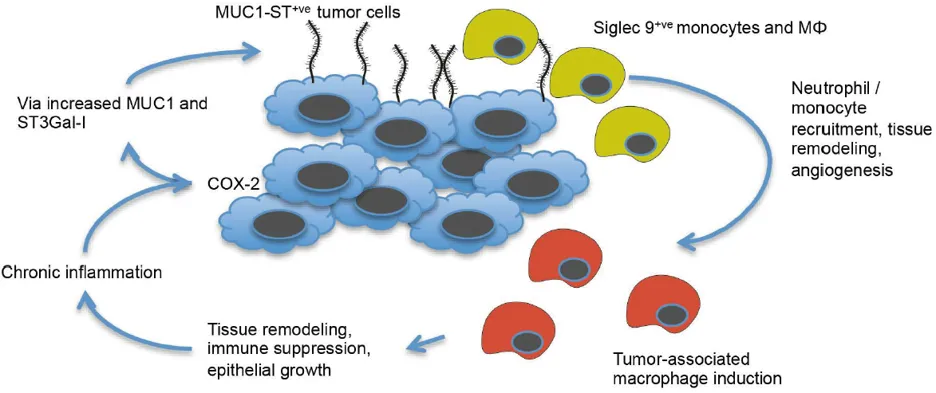
MUC1 是一种在多种肿瘤中高表达的糖蛋白,其糖基化模式改变与肿瘤进展密切相关。研究构建了三种 MUC1 变体:
MUC1-ungly:仅含蛋白骨架,无糖基化修饰;
MUC1-T:有基础糖基化,无唾液酸化;
MUC1-ST:同时具备糖基化与唾液酸化(异常修饰)。
实验显示,仅 MUC1-ST 能特异性结合单核 / 巨噬细胞,且这种结合依赖唾液酸化修饰。进一步研究发现,MUC1-ST 主要与单核 / 巨噬细胞表面的 Siglec-9 结合,使用抗 Siglec-9 抗体可显著阻断这种相互作用,证实 Siglec-9 是 MUC1-ST 的关键受体。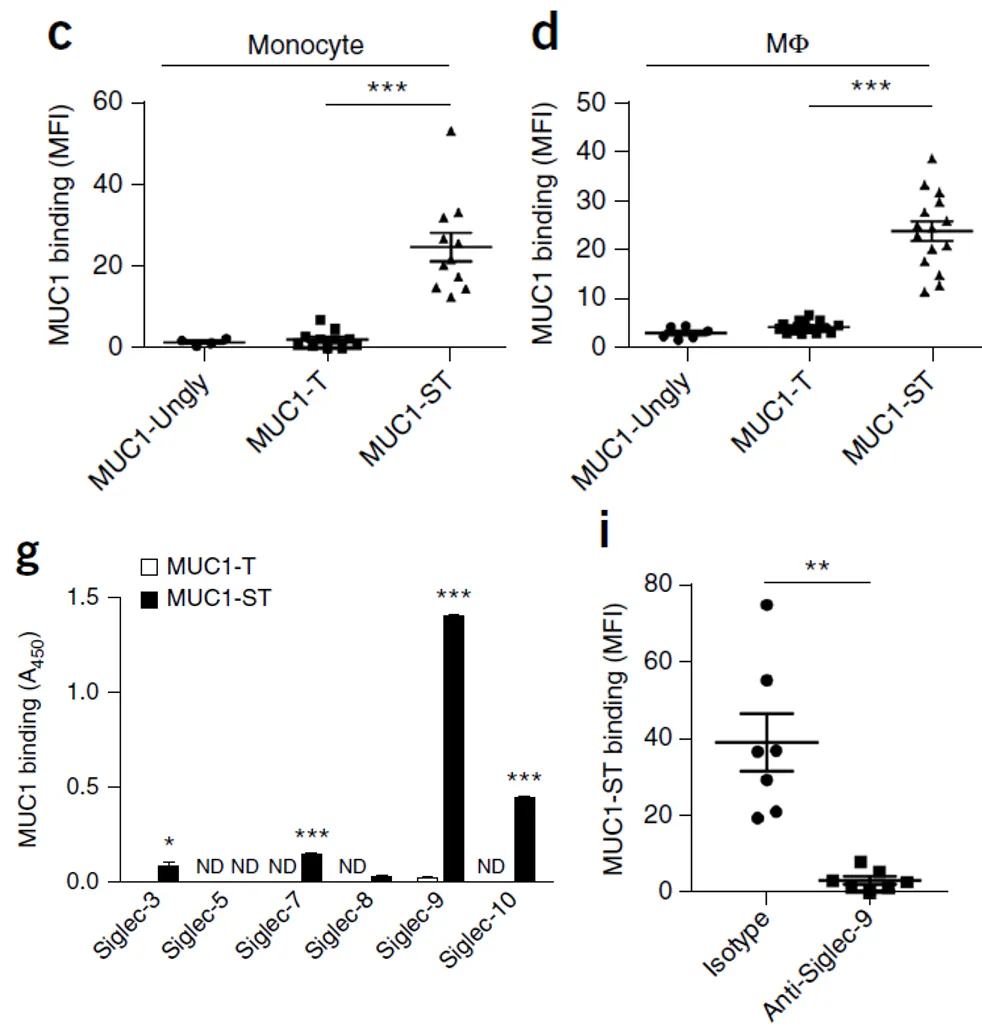
图1 MUC1-ST与单核/巨噬细胞Siglec-9结合
MUC1-ST 与 Siglec-9 结合后,显著改变单核细胞的分泌谱:
促炎因子 IL-6 分泌增加,参与炎症微环境形成;
巨噬细胞集落刺激因子(MCSF)释放增多,促进单核细胞向巨噬细胞分化;
血管生成相关因子 PAI-1 上调,为肿瘤侵袭转移提供条件。
ELISA 验证表明,这些因子的分泌上调均依赖 MUC1-ST 与 Siglec-9 的结合,阻断 Siglec-9 后分泌水平显著降低。此外,MUC1-ST 处理可促进单核细胞产生一氧化氮(NO),而高浓度 NO 可抑制 T 细胞功能,提示其参与免疫抑制微环境构建。
单核细胞向巨噬细胞的分化方向决定免疫微环境性质。研究发现,MUC1-ST 处理使分化后的巨噬细胞:
表面共刺激分子 CD86 及 IL-12 表达显著下调;
对 CD8⁺T 细胞的增殖及激活分子 CD69 表达有显著抑制作用;
对树突状细胞(DC)的分化成熟也具有抑制作用。
这些效应可被 Siglec-9 抗体或 IL-6 中和抗体逆转,表明 MUC1-ST/Siglec-9 通过 IL-6 依赖方式,诱导单核细胞向免疫抑制性巨噬细胞分化,削弱适应性免疫应答。
MUC1-ST 与巨噬细胞结合后,通过 Siglec-9 调控其功能表型:
分泌 M-CSF、PAI-1 及表皮生长因子(EGF)增加,参与巨噬细胞自我更新、肿瘤侵袭及细胞增殖调控;
高表达 M2 型巨噬细胞标志物 CD206、CD163;
免疫检查点分子 PD-L1 及 IDO 表达上调,强化免疫抑制。
功能实验显示,这类巨噬细胞对 CD8⁺T 细胞的抑制作用可被 Siglec-9 抗体部分逆转,证实 Siglec-9 在巨噬细胞促肿瘤表型诱导中的核心作用。
传统观点认为 Siglec 家族通过 SHP-1 传递抑制信号,但研究发现 MUC1-ST/Siglec-9 相互作用并未激活 SHP-1 磷酸化,而是通过非经典通路:
显著增强巨噬细胞内钙离子转运,且该效应依赖 Siglec-9;
钙离子通道抑制剂维拉帕米可抑制促肿瘤因子分泌;
激活 MEK-ERK 通路,MEK 抑制剂可减少促肿瘤因子分泌,并部分恢复 CD8⁺T 细胞增殖能力。
综上,MUC1-ST 通过与 Siglec-9 结合,激活钙离子 / MEK-ERK 信号轴,诱导单核 / 巨噬细胞功能重塑。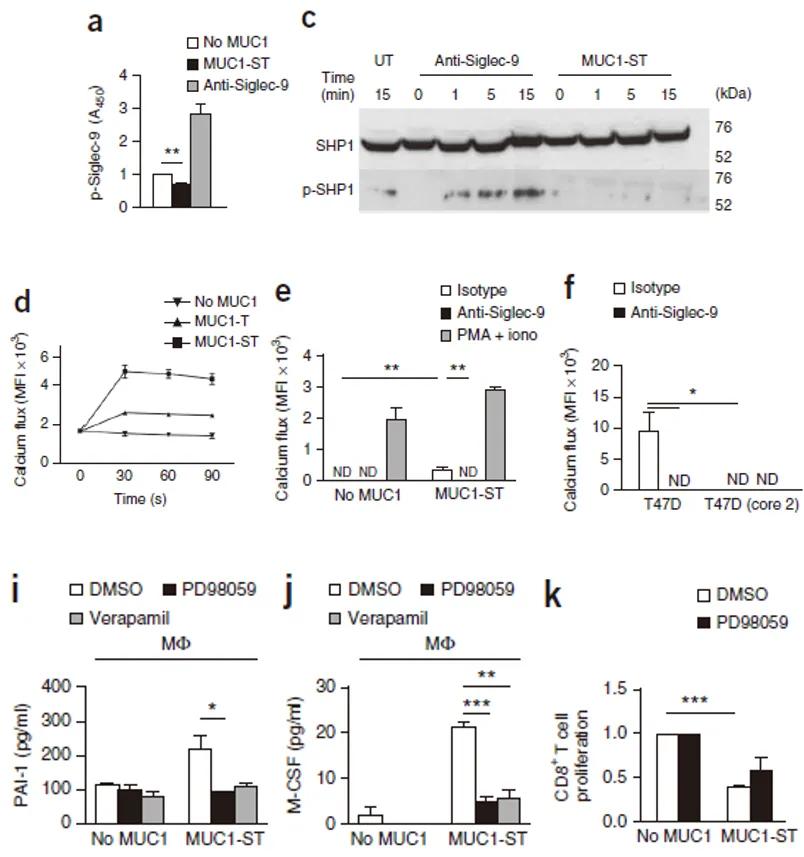
图2 MUC1-ST通过Siglec-9激活MEK-ERK通路
该研究揭示了肿瘤细胞通过 MUC1 异常唾液酸化与 Siglec-9 结合,驯化单核 / 巨噬细胞的新机制,拓展了对肿瘤免疫逃逸的理解。这一发现为靶向 Siglec-9 或 MUC1 异常糖基化的抗肿瘤免疫治疗提供了理论依据,提示针对 Siglec-9 的抗体药物或糖基化抑制剂可能成为逆转肿瘤免疫抑制微环境的潜在策略。
















