慢加急性肝衰竭(Acute-on-chronic liver failure, ACLF)是一种以系统性炎症反应和多器官功能衰竭为特征的重症肝病综合征,具有极高的病死率。其核心病理特征包括肝细胞大量坏死、肝脏再生能力障碍及免疫代谢紊乱,如何精准评估患者预后并探索有效的促肝再生治疗策略,始终是临床实践中亟待解决的关键问题。
Syndecan 家族作为内皮细胞和实质细胞表面主要的硫酸乙酰肝素蛋白多糖(heparan sulfate proteoglycans, HSPGs),在细胞间通讯、信号转导及组织修复中发挥重要作用。其中,Syndecan-1(SDC-1)主要表达于肝细胞和上皮细胞表面,通过其胞外段连接的 3 条硫酸肝素(heparan sulfate, HS)链,作为整合素的结合伴侣或生长因子的共受体,参与调控细胞粘附、迁移、增殖及内信号传导等多种生物学过程。在感染或组织损伤状态下,SDC-1 可从细胞表面脱落进入血液循环,其循环水平被证实可反映血管内皮损伤程度及疾病严重程度,是多种重症疾病的潜在预后标志物。然而,SDC-1 在 ACLF 中的具体作用机制、临床预后价值及作为治疗靶点的潜力尚未明确,相关研究为解析 ACLF 的病理生理过程提供了新的研究视角。
临床队列研究通过检测不同肝脏疾病患者的血清 SDC-1 水平发现,ACLF 患者的基线 SDC-1 浓度显著高于肝硬化、慢性乙型肝炎及肝细胞癌患者,提示 SDC-1 的异常升高可能与 ACLF 的急性加重过程密切相关。进一步相关性分析显示,血清 SDC-1 水平与总胆红素(TBIL)、天门冬氨酸转氨酶(AST)、中性粒细胞计数等炎症及肝功能指标呈正相关,且与 MELD 评分、COSSH-ACLF II 评分等经典预后评分系统显著相关,表明其可综合反映 ACLF 患者的肝脏损伤程度和全身炎症状态。
基于患者 28 天及 90 天的随访结局分析显示,90 天内死亡或接受肝移植的 ACLF 患者,其基线血清 SDC-1 水平显著高于存活患者;病情持续恶化的患者血清 SDC-1 水平亦明显高于病情好转者。这一结果提示,血清 SDC-1 水平可作为评估 ACLF 患者短期预后的潜在生物标志物,其动态变化可能反映疾病进展趋势。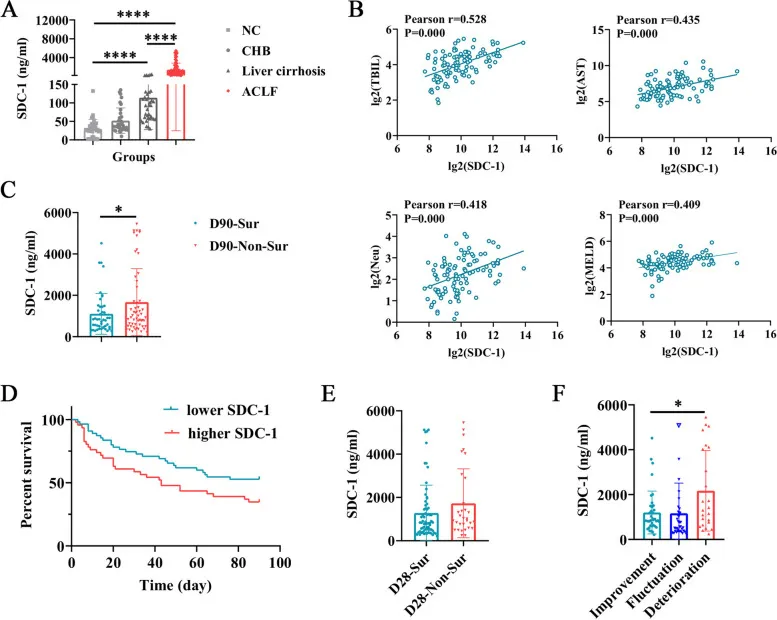
ACLF患者的SDC-1水平及其与ACLF患者预后的关系
为提高 ACLF 预后预测的精准性,研究通过正交偏最小二乘判别分析(OPLS-DA)筛选出对预后影响最显著的 5 项指标,包括 SDC-1、TBIL、国际标准化比值(INR)、白蛋白及总蛋白,并结合 Cox 回归分析确定年龄、上消化道出血(UGIB)、SDC-1 和 INR 为 ACLF 患者的独立预后因素,进而构建了新型预后模型 UIAS(计算公式:UIAS = 0.076× 年龄 + 0.001×SDC-1 + 1.454×INR + 2.854×UGIB - 12.165,其中无 UGIB 者 UGIB=1,有 UGIB 者 UGIB=2)。
验证结果显示,UIAS 评分与 MELD、COSSH-ACLF II 及 Child-Pugh 评分均呈显著相关性,且在预测 ACLF 患者 28 天生存率方面表现出更高的效能(AUROC 更高)。尤其在乙型肝炎相关 ACLF 患者中,UIAS 对 28 天病情恶化和 90 天死亡率的预测 AUROC 分别达 0.897 和 0.859,显著优于传统的 COSSH-ACLF II 评分,证实其在临床预后评估中的实用价值。
为探究 SDC-1 在 ACLF 中的病理机制,研究采用四氯化碳(CCl4)联合 D - 氨基半乳糖(D-GalN)和脂多糖(LPS)诱导构建小鼠 ACLF 模型。该模型表现出典型的 ACLF 特征:血清 ALT、AST 水平显著升高,肝组织出现广泛肝细胞坏死、炎症细胞浸润及肝纤维化(Masson 染色证实),透射电镜可见肝细胞线粒体肿胀、嵴结构消失,Tunel 染色显示肝细胞凋亡增加,同时伴随肝脏巨噬细胞和中性粒细胞浸润增多。
在该模型中,ACLF 小鼠血清 SDC-1 水平显著升高,与临床患者表现一致;而肝组织中 SDC-1 的表达则明显下调且分布紊乱(正常小鼠 SDC-1 主要表达于肝细胞和肝血窦内皮),提示细胞表面 SDC-1 的脱落可能是循环 SDC-1 升高的主要原因,且其表达缺失可能参与肝损伤的病理过程。
基于 SDC-1 的生物学功能,研究选用两种干预药物:舒洛地特(SDX,可抑制 SDC-1 的降解与脱落)和硫酸肝素(HS,可补充胞外硫酸肝素链,促进糖萼修复),评估其对 ACLF 小鼠的治疗作用。结果显示:
肝损伤改善:SDX 和 HS 处理显著减轻 ACLF 小鼠的肝细胞坏死和炎症浸润,线粒体结构损伤得到缓解,血清 ALT、AST 水平降低;
凋亡抑制:Tunel 染色及蛋白检测显示,两种药物均减少肝细胞凋亡,下调 Cleaved-caspase3 表达,上调抗凋亡蛋白 Bcl2/Bax 比值;
肝再生促进:SDX 和 HS 可增加细胞周期蛋白 D1、细胞周期蛋白 E1 及增殖细胞核抗原(PCNA)的表达,提示肝细胞增殖能力增强。
同时,药物处理可部分逆转 ACLF 小鼠肝组织 SDC-1 的下调,并降低血清 SDC-1 水平,表明稳定细胞表面 SDC-1 表达或补充其功能片段,可能是改善肝损伤的关键机制。
为解析 SDX 和 HS 的作用机制,蛋白质组学分析显示,SDX 处理组差异蛋白富集于 cAMP、TGF-β 及 MAPK 信号通路,而 HS 处理组差异蛋白主要富集于 TGF-β 和 JAK/STAT 信号通路。鉴于 JAK/STAT 通路在肝细胞抗凋亡和促增殖中的已知作用,进一步通过 Western blotting 验证发现,SDX 和 HS 均可显著提高 ACLF 小鼠肝脏中 JAK1 和 STAT3 的磷酸化水平,提示其可能通过激活 JAK1/STAT3 信号通路,发挥促肝再生和抗凋亡效应。这一发现揭示了 SDC-1 相关干预改善 ACLF 的潜在分子机制,即通过稳定 SDC-1 表达或补充 HS 链,激活 JAK1/STAT3 通路,恢复肝细胞增殖能力并抑制凋亡。
现有研究系统阐明了 SDC-1 在 ACLF 中的双重角色:作为循环生物标志物,其基线水平可有效预测患者短期预后,基于此构建的 UIAS 模型显著提升了 ACLF 预后评估的精准性;作为功能分子,肝细胞表面 SDC-1 的表达缺失与肝再生障碍、凋亡增加密切相关,而靶向 SDC-1 的干预(如 SDX 抑制其脱落、HS 补充硫酸肝素链)可通过激活 JAK1/STAT3 通路,促进肝再生并减轻肝损伤。
这些发现不仅为 ACLF 的预后评估提供了新的生物学标志物和工具,也为开发以 SDC-1 为靶点的治疗策略奠定了理论基础。未来研究需进一步探索 SDC-1 调控 JAK1/STAT3 通路的具体分子机制,并在更大规模临床队列中验证其预后价值,为 ACLF 的精准诊疗提供更充分的证据支持。














