α-Klotho:解码慢性肾病贫血的关键调控因子
近年来研究发现,抗衰老基因 α-Klotho(KL)的表达异常与 CKD 贫血存在密切关联,其在肾脏特异性高表达的特性使其成为连接肾脏功能与造血调节的关键分子。尽管多项临床研究已证实 CKD 伴贫血患者的 α-Klotho 水平显著降低,但这种分子变化背后的调控网络仍有待深入解析。
- 最新进展
- 产品信息
最新进展
引言
慢性肾脏病(CKD)的进展常伴随贫血并发症,这种正常红细胞正常色素性贫血不仅降低患者生活质量,更会加速疾病恶化。近年来研究发现,抗衰老基因 α-Klotho(KL)的表达异常与 CKD 贫血存在密切关联,其在肾脏特异性高表达的特性使其成为连接肾脏功能与造血调节的关键分子。尽管多项临床研究已证实 CKD 伴贫血患者的 α-Klotho 水平显著降低,但这种分子变化背后的调控网络仍有待深入解析。本文系统梳理 α-Klotho 与促红细胞生成素、铁代谢、维生素 D 及炎症反应的相互作用,揭示其在肾性贫血中的核心调控地位。
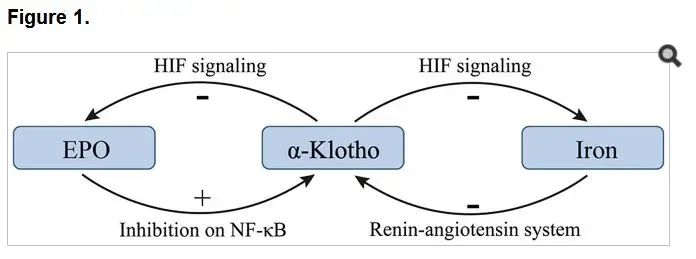
α-Klotho 与促红细胞生成素的双向调控网络
促红细胞生成素(EPO)作为红细胞生成的核心调节因子,其合成障碍是 CKD 贫血的直接诱因。研究证实 α-Klotho 与 EPO 存在精密的负反馈调节机制:EPO 可促进 α-Klotho 表达,而 α-Klotho 反过来抑制 CKD 状态下 EPO 的过度产生,形成动态平衡的调控环路。
在肾脏损伤进程中,α-Klotho 的渐进性下调打破了这种平衡。尿毒症环境诱导的内皮细胞损伤会激活核因子 -κB(NF-κB)通路,而 EPO 可通过抑制该通路活性维持 α-Klotho 的稳定表达。动物实验显示,α-Klotho 缺失小鼠通过激活缺氧诱导因子(HIF)信号通路,呈现红细胞生成亢进现象,伴随肾脏 EPO 合成与分泌的代偿性增加。这种代偿机制提示,α-Klotho 表达降低可能是机体应对 EPO 合成不足的适应性反应。
α-Klotho 对铁代谢的多维调节作用
铁代谢紊乱是 CKD 贫血的重要驱动因素,而 α-Klotho 在此过程中扮演双重调节角色。临床数据显示,70 例不同分期 CKD 患者的血清 α-Klotho 水平与铁蛋白、转铁蛋白饱和度呈显著负相关,且随疾病进展,α-Klotho 降低与成纤维细胞生长因子 23(FGF23)升高的趋势同步增强。
实验证据表明,铁超载可从转录和翻译水平抑制肾脏 α-Klotho 表达,而铁螯合治疗能有效逆转血管紧张素 II 诱导的 α-Klotho 下调。这提示肾素 - 血管紧张素系统可能通过调控铁稳态参与 α-Klotho 的表达调节。值得注意的是,铁缺乏状态下 α-Klotho 的代偿性高表达,可能通过抑制铁吸收相关蛋白活性维持铁代谢平衡,这种调节机制在 CKD 贫血的病理进程中具有重要意义。
维生素 D 轴与 α-Klotho 的交叉对话
维生素 D 代谢异常在 CKD 患者中极为常见,其与 α-Klotho 形成的调控网络深刻影响造血功能。研究证实,1,25 - 二羟基维生素 D 可直接上调 α-Klotho 表达,而甲状旁腺激素(PTH)通过促进活性维生素 D 生成间接增强 α-Klotho 的转录活性。
这种调控呈现精密的负反馈特征:维生素 D 在刺激 FGF23 和 α-Klotho 表达的同时,会通过抑制 25 - 羟基维生素 D1α- 羟化酶活性限制自身合成。在 CKD 进展中,肾脏羟化酶活性下降导致活性维生素 D 不足,进一步降低 α-Klotho 水平,形成恶性循环。这一轴系的紊乱不仅影响钙磷代谢,更通过多种途径加重肾性贫血。
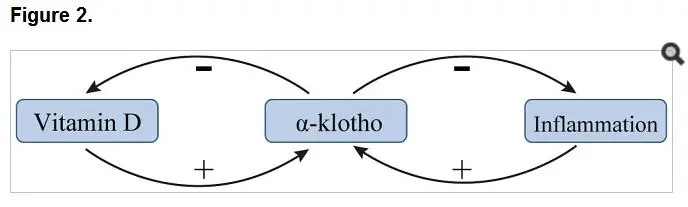
α-Klotho 的抗炎特性及其造血保护作用
慢性炎症是 CKD 贫血的重要驱动因素,而 α-Klotho 具有显著的抗炎调节功能。作为多种炎性细胞因子的天然抑制剂,α-Klotho 可通过降低 NF-κB 的 DNA 结合能力,稳定 NF-κB 抑制剂 α 复合物,从而阻断尿毒症毒素诱导的炎症通路激活。
在 CKD 病理环境中,α-Klotho 表达降低使其抗炎作用减弱,导致肿瘤坏死因子 -α、白细胞介素 - 6 等促炎因子释放增加。这些炎性介质不仅直接抑制红系祖细胞增殖,还通过上调铁调素水平干扰铁的利用,形成 “炎症性贫血” 的病理基础。因此,α-Klotho 的抗炎特性使其成为连接肾脏损伤与造血功能障碍的关键分子纽带。
总结与展望
α-Klotho 通过与 EPO 调控、铁代谢、维生素 D 轴及炎症反应的多维度交互作用,在 CKD 贫血中发挥核心调节功能。研究提示,贫血状态下 α-Klotho 的低表达可能是机体的代偿机制 —— 通过解除对 EPO 合成的抑制、上调血清铁水平及维生素 D 活性,部分缓解贫血症状。
深入解析 α-Klotho 在肾性贫血中的作用机制,有望为 CKD 并发症的治疗提供全新靶点。未来研究需进一步明确 α-Klotho 表达调控的分子机制,探索通过基因修饰或药物干预恢复其水平的可行性,为改善 CKD 患者的造血功能及生存质量开辟新途径。
产品信息













