透明质酸酶(Hyaluronidase, HAase)是一类特异性降解透明质酸(HA)及部分糖胺聚糖的糖苷酶,通过切割 β-1,4 糖苷键将大分子底物分解为小分子片段(图1)。这一特性使其成为生物医药领域的关键工具:作为药物辅剂,可破坏细胞外基质 HA 结构,提升共注射药物的组织通透性,加速吸收;在临床中,用于眼科手术防黏连、整形外科缓解 HA 填充并发症,还能作为抗肿瘤佐剂提高皮下注射药物剂量,增强疗效(图2)。
自 20 世纪 50 年代商业化以来,透明质酸酶的发展始终依赖下游纯化工艺的革新。从早期动物组织提取到如今重组蛋白生产,工艺升级直接推动产品纯度、安全性与规模化能力的提升,成为其广泛应用的核心支撑。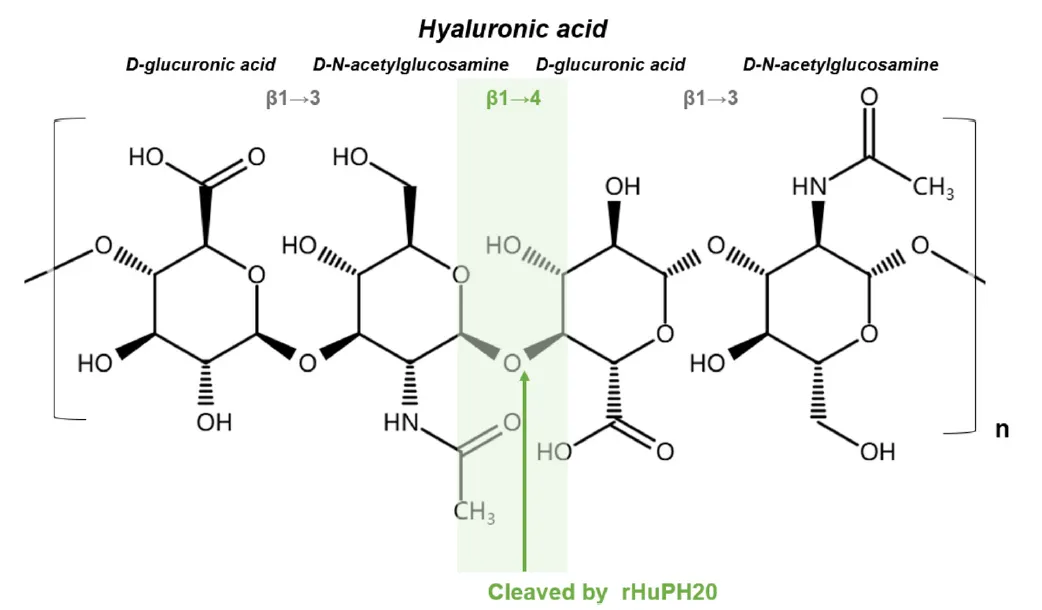
图1. 透明质酸酶rHuPH20切割β1-4糖苷键
图2. 透明质酸酶作为皮下注射药物辅料,可以催化细胞外基质中透明质酸的降解,从而允许大容量皮下注射,增加共给药蛋白质的分散和吸收
早期透明质酸酶主要从牛、羊睾丸组织提取,这类原料 HAase 含量高、活性稳定。纯化以两步亲和层析为核心:第一步用 Blue Sepharose Fast Flow 填料,通过疏水作用与核酸亲和性去除大部分杂蛋白与核酸;第二步用 Capto Lentil Lectin 填料,利用其对 HAase 糖基的特异性结合,实现目标蛋白富集。
SDS-PAGE 与 Western blot 验证显示,该工艺可分离出活性 HAase(如牛源样品经 Capto Lentil Lectin 洗脱后呈单一目标条带),但存在显著缺陷:产品纯度低,残留动物蛋白酶、免疫球蛋白等杂质,易引发人体过敏;原料供应受养殖周期、疾病影响,难以规模化;动物组织可能携带病原体,存在生物安全风险。这些问题推动技术向重组蛋白方向转型。
重组人 PH20(rHuPH20)是目前应用最广的透明质酸酶,天然存在于人类精子中,中性与酸性环境下均有活性,半衰期短、静脉注射安全,是高浓度药物皮下注射的理想佐剂。其主流表达系统为 CHO 细胞,下游纯化以多步层析组合为基础,通过离子交换、疏水、糖基亲和层析联用,可使产品纯度超 90%,比活达 100,000 USP Units/mg 以上,HCP 残留<1%,内毒素<0.5 EU/mg,满足临床标准。
为简化流程,His 标签技术成为关键:His 标签分子量仅 0.8 kDa,远小于 GST 标签(26 kDa),对 rHuPH20 结构与活性影响极小。带有 His 标签的 rHuPH20 可通过 IMAC 层析纯化,用 HisTrap HP 预装柱,以 35 mM 咪唑缓冲液结合、200 mM 咪唑洗脱,高效捕获目标蛋白。将 “阴离子层析(Q Sepharose 柱,0-100% NaCl 线性洗脱)+His 标签亲和层析” 联用,还可纯化出用于晶体结构解析的高纯度 rHuPH20。
针对商业化需求,Cytiva Protein Select 填料展现显著优势:通过标签自裂解机制,单一步骤完成 rHuPH20 捕获与标签切除,无需额外酶切;蛋白载量达 20 g/L,经 50 次再生仍稳定,且可从实验室小试无缝过渡到工业生产,适配细菌、哺乳动物等多种表达系统,为规模化生产提供高效方案。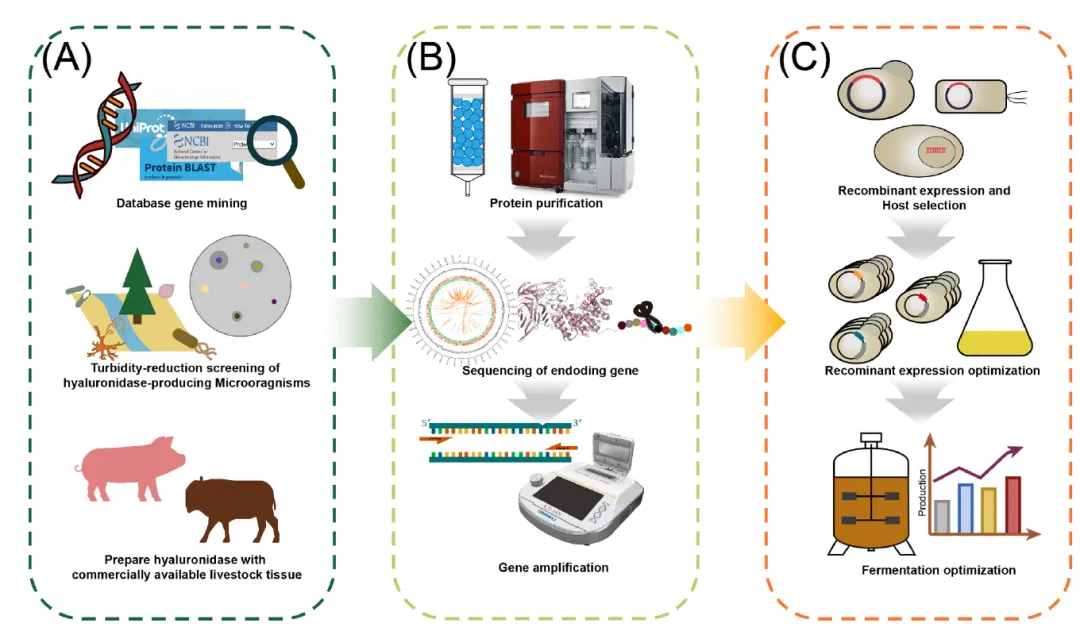
图3. 重组透明质酸酶获取流程(A)从自然资源或数据库中挖掘新型透明质酸酶;(B)解码新型透明质酸酶序列;(C)实现高水平的重组透明质酸酶生产
为确保产品安全有效,需严格控制三大关键属性:
纯度与活性:用 SDS-PAGE、HPLC 验证纯度,USP 底物法测定比活,保障活性稳定;
杂质清除:ELISA 测 HCP 残留,鲎试剂法测内毒素,PCR 法控宿主 DNA,避免不良反应;
结构完整:圆二色谱分析二级结构,质谱验证分子量与糖基化修饰,确保与天然蛋白一致。
透明质酸酶纯化工艺实现了从 “动物提取” 到 “重组生产” 的跨越,通过多步层析、标签技术与新型填料的应用,解决了传统工艺的纯度与安全问题。未来,随着连续层析、高通量筛选技术的发展,工艺将进一步向高效化、低成本化升级,为透明质酸酶在医学、美容等领域的广泛应用奠定更坚实的技术基础。