PD-L1 靶向抗体作为肿瘤免疫治疗的核心力量,通过阻断 PD-L1 与 PD-1 的免疫抑制结合,恢复 T 细胞对肿瘤的杀伤能力,目前已成为 16 种特定癌症及不限癌种适应症的标准治疗方案。本文基于《Nature Reviews Drug Discovery》综述及 IQVIA 全球临床试验数据,系统梳理 PD-L1 抗体临床开发的最新动态,解析组合疗法创新、试验设计变革及区域招募差异,为理解该领域发展脉络提供关键参考。
自 2017 年 9 月首次调研以来,美国 FDA 已为 PD-L1 单抗及 PD-1/PD-L1 联合疗法新增 23 项批准;全球范围内,随着 PD-L1 靶向药物研发推进,叠加 4 种新 PD-1 抗体上市(与 PD-L1 抗体协同构成靶向通路药物矩阵),目前 PD-L1 相关获批抗体药物总数达 9 种,覆盖黑色素瘤、非小细胞肺癌、肾癌、子宫内膜癌等多个癌种,标志着 PD-L1 靶向治疗从 “早期探索” 正式迈入 “广谱临床应用” 阶段。
自 2006 年起,全球累计启动 3362 项 PD-L1 相关临床试验(含 PD-L1 单抗单药、PD-L1 与 PD-1 抗体联用及 PD-L1 抗体与其他疗法组合);截至 2019 年 9 月,2975 项试验仍在积极推进,计划招募超 50 万名患者。与 2017 年同期相比,新增 1469 项活跃试验,覆盖几乎所有癌症类型与治疗阶段(从晚期二线到一线辅助治疗),充分展现 PD-L1 靶向领域的高速发展态势。
当前 76% 的 PD-L1 相关活跃临床试验,均在探索 PD-L1 抗体与其他疗法的联用潜力,包括肿瘤免疫疗法(如 CTLA-4 抗体)、靶向疗法(如 VEGF 抑制剂)、化疗或放疗。这一转变源于 PD-L1 单抗单药治疗的局限性 —— 部分患者因肿瘤微环境免疫抑制强、PD-L1 表达水平低等因素存在原发耐药,而组合疗法可通过多机制协同,打破免疫抑制微环境,提升治疗响应率。
FDA 近年批准的 PD-L1 相关组合方案,为领域发展提供重要方向:一是 PD-L1 抗体与靶向疗法联用,如 avelumab 联合 axitinib 获批用于肾癌治疗,借 VEGF 通路抑制改善肿瘤血管紊乱,增强 PD-L1 抗体介导的免疫细胞浸润;二是 PD-L1 抗体与靶向疗法、化疗的三联方案,如 atezolizumab 联合 bevacizumab 与化疗获批用于非小细胞肺癌,通过 “免疫激活 + 血管调节 + 肿瘤杀伤” 三重机制,显著提升晚期患者客观缓解率与生存期。
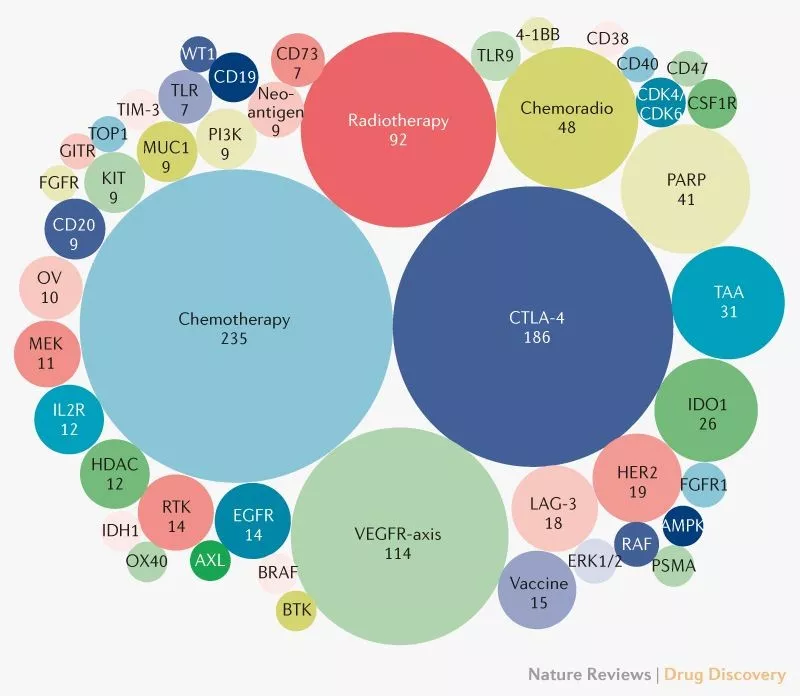
PD-L1 抗体组合疗法的联合靶标已达 295 种,两年内新增 136 个,其中与 PD-L1 协同作用的核心靶标聚焦三类:联合化疗(235 项新试验),利用化疗释放肿瘤抗原的特性,增强 PD-L1 抗体对 T 细胞的激活效果;联合 CTLA-4 抗体(186 项新试验),通过双免疫检查点阻断,协同解除 T 细胞的双重抑制;联合 VEGF 靶向药(114 项新试验),目前已获 4 项 FDA 批准,是 PD-L1 抗体组合中最成熟的策略之一。
2014-2019 年间,每项 PD-L1 相关临床试验的平均计划招募人数,从 429 人降至 129 人,降幅达 65%。核心原因在于:早期 PD-L1 抗体临床试验多聚焦黑色素瘤、非小细胞肺癌等 “主流癌种”,患者基数大;随着这些癌种的 PD-L1 治疗方案逐渐成熟,新试验更多转向胆管癌、神经内分泌肿瘤等罕见癌症,这类癌种患者总量少,客观限制了单试验招募规模,推动试验设计向 “小而精” 转变。
全球主要临床试验基地中,美国 PD-L1 抗体试验招募率最低,推测因 PD-L1 靶向药物已广泛作为标准治疗,潜在受试患者池(未接受过 PD-L1 治疗的患者)持续萎缩;而中国 PD-L1 抗体单药试验的招募率约为美国的 6 倍,联合治疗试验招募率约为美国的 4 倍。中国每年新发 400 余万癌症病例,且多数患者尚未接受过 PD-L1 靶向治疗,满足入组标准的患者数量充足,成为全球 PD-L1 临床试验招募的核心区域。
中国自主研发的 PD-L1 相关联合疗法(如基于国产 PD-1/PD-L1 抗体的组合方案)及配套临床试验推进迅速,例如信迪利单抗、特瑞普利单抗等药物的临床开发仅耗时 26-45 个月,快速招募能力是关键支撑。随着中国加入 ICH,其 PD-L1 抗体临床试验数据已具备全球互认潜力,有望支持药物在其他 ICH 成员国注册,为全球 PD-L1 靶向治疗研发提供重要数据与患者资源支撑。
当前 PD-L1 抗体临床开发需突破两大核心问题:一是缺乏针对 PD-L1 组合疗法的特异性生物标志物,难以精准筛选真正能从治疗中获益的患者,导致部分试验存在 “无效入组”;二是多数患者接受 PD-L1 抗体治疗后会出现耐药或复发,亟需解析耐药机制(如 PD-L1 表达下调、肿瘤微环境免疫沙漠化),开发对抗耐药的创新组合方案(如 PD-L1 抗体联合新型免疫激动剂)。此外,新兴市场的庞大患者资源,有望加速新生物标志物与疗法的验证,推动 PD-L1 靶向治疗向 “更精准、更长效” 方向发展,最终为全球癌症患者提供更优治疗选择。