基于荧光素酶的细胞株工程技术:原理及在生物医学研究中的应用
荧光素酶在氧气和ATP存在条件下,可催化底物荧光素(luciferin)发生氧化反应,产生可检测的光信号,无需外部激发光。
- 最新进展
- 产品信息
Q1:使用荧光素酶标记肿瘤细胞株进行体内研究的基本原理是什么?
活体成像技术能够无创、实时地观察活体动物体内的肿瘤生长、转移及基因表达等生物学过程。在多种成像技术(如超声、CT、MRI、PET)中,基于荧光素酶(Luc)的生物发光成像(BLI)具有独特优势。荧光素酶在氧气和ATP存在条件下,可催化底物荧光素(luciferin)发生氧化反应,产生可检测的光信号,无需外部激发光。该反应仅发生于活细胞内,发光强度与细胞数量呈线性关系。由于红光(>600 nm)不易被血红蛋白吸收,光子能够穿透组织,被高灵敏度制冷CCD相机捕获,从而实现体内肿瘤负荷的精确量化。
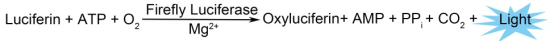
Q2:荧光素酶的表达是否会改变细胞自身功能?
大量研究证实,荧光素酶的表达不会干扰细胞正常的生理活动,包括增殖、迁移或信号转导。其稳定基因组整合保障了表达在代际间的持续性,是一种可靠的长期研究工具。
Q3:荧光素酶标记细胞株的稳定性如何?是否需要进行抗生素筛选?
若荧光素酶基因已稳定整合于基因组中,其表达在细胞分裂和分化过程中仍能保持一致。虽然短期培养不一定需要抗生素加压,但长期传代可能导致转基因沉默或丢失。建议定期施加抗生素压力或从原始库存重新培养细胞,以维持信号强度。
Q4:为什么体内信号可能出现微弱或无法检测?
以下因素会影响信号检测:
仪器灵敏度:高性能制冷CCD相机和遮光良好的成像暗箱是捕获弱光信号的关键。
底物动力学:腹腔注射荧光素后约10–20分钟信号达到峰值,持续约30分钟;静脉注射起效更快但持续时间较短。标准剂量为150 mg/kg。
细胞位置与数量:信号强度每深入1厘米约衰减10倍。皮下移植可能只需数百个细胞,而深部病灶需更多细胞。
底物质量:应通过标准曲线验证不同批次的荧光素,以确保达到饱和动力学。
Q5:体外荧光素酶检测常见的注意事项有哪些?
时间控制:加入底物后荧光素酶活性每30分钟衰减一半,需尽快完成检测。
微孔板选择:白色不透明板可减少孔间干扰;黑色板会吸收信号,降低灵敏度。
底物保存与使用:荧光素需避光保存于–20°C,且应使用饱和浓度以确保检测准确性。
Q6:为何小鼠成像前需进行脱毛处理?
毛发会阻挡、吸收及散射光线,并产生强烈自发荧光。脱毛操作可显著降低背景噪声,提高信噪比。
Q7:能否可靠检测深部组织信号?
尽管信号强度随深度呈指数衰减,荧光素酶成像仍适用于皮下及多数原位模型。在小鼠中,光信号可穿透3–4厘米,足以满足大多数临床前研究需求。
Q8:除肿瘤研究外,荧光素酶技术还有哪些应用?
该技术具有广泛用途:
干细胞追踪:在再生医学研究中监测细胞迁移与定植。
感染模型:标记病原体(如细菌)以研究宿主-病原体互作。
基因调控:实时报告启动子活性或蛋白质相互作用。
药物筛选:通过动态读取细胞反应来评估化合物效果。
Q9:高质量的荧光素酶标记细胞株应具备哪些特征?
理想细胞株应满足:
稳定基因组整合:保障代际间表达一致性。
功能验证:经过STR鉴定、物种验证及荧光素酶活性检测。
无支原体污染:确保体内外实验结果可重复。
高信号强度:支持高灵敏度的体内外检测。
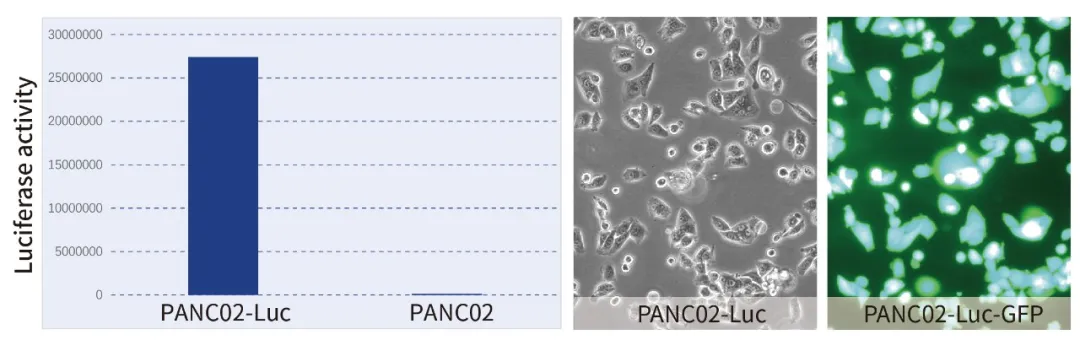
示例验证:
以荧光素酶/GFP双标记的胰腺导管腺癌细胞株(如PANC02-Luc/GFP)为例,可通过生物发光(定量)和荧光(定位)实现多角度监测,为实验设计提供更大灵活性。