- 最新进展
- 产品信息
随着全球生活水平不断提升,肥胖与超重发病率持续攀升,已成为严峻的公共健康挑战。营养过剩所导致的肥胖目前仍缺乏有效治疗手段,其背后涉及复杂的代谢与免疫调控机制。值得注意的是,肥胖常伴随低度慢性炎症状态,进而诱发代谢综合征,然而这一过程的具体分子机制尚未明确。
2021年4月15日,西班牙国立癌症研究中心团队在《Nature Metabolism》上发表题为“Inhibition of the IL-17A axis in adipocytes suppresses diet-induced obesity and metabolic disorders in mice”的研究论文,揭示白细胞介素-17A(IL-17A)信号轴在肥胖发生中的关键作用,为肥胖治疗提供了新的潜在靶点。

1.肥胖为何常伴随代谢和免疫功能障碍?
全球目前有19亿成年人超重,6亿人患有肥胖,预计至2030年肥胖人口将超过全球半数。肥胖不仅由能量摄入与消耗失衡引起,更会进一步导致Ⅱ型糖尿病、高血压、非酒精性脂肪肝、心血管疾病及部分恶性肿瘤等一系列代谢性疾病。营养物质本身可诱发炎症反应,并伴随IL-17A水平升高,提示营养过剩可能通过免疫调节机制推动肥胖与代谢紊乱的发生。
2.IL-17A如何影响脂肪细胞功能?
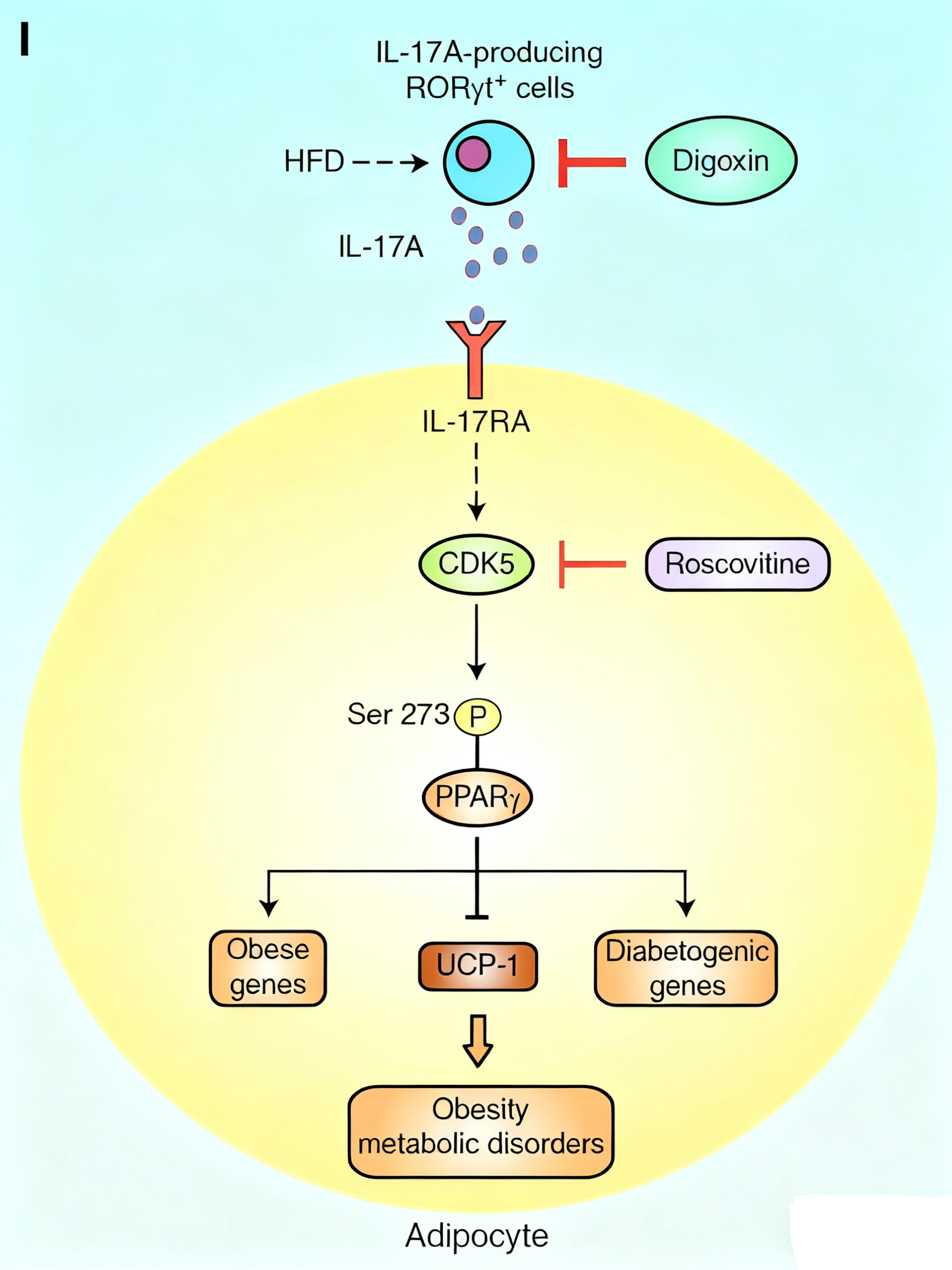
脂肪组织可分为白色脂肪(WAT)和褐色脂肪(BAT),前者主要用于能量储存,后者则负责产热与能量消耗。在特定条件下,白色脂肪可发生“褐变”,获得类似褐色脂肪的产热特性。该研究通过多种方式抑制IL-17A信号——包括使用地高辛(digoxin)阻断IL-17A、脂肪细胞特异性敲除IL-17A受体(IL-17RA),或采用RORγt抑制剂——均显著促进白色脂肪褐变,增强能量消耗,从而有效抑制高脂饮食诱导的肥胖及糖脂代谢异常。
3.IL-17A是否独立于瘦素通路发挥作用?
研究进一步表明,IL-17A信号轴并不依赖于经典的瘦素调控通路。在分子机制上,IL-17A通过CDK5依赖的方式诱导脂肪细胞中PPARγ转录因子Ser273位点的磷酸化,进而改变一系列与肥胖和胰岛素抵抗相关基因的表达。这一机制在人类样本中也得到验证:对75例病态肥胖患者的内脏脂肪组织进行分析,显示IL-17A信号活性与肥胖相关基因表达显著相关。
4.靶向IL-17A是否具有临床转化潜力?
该研究不仅确立了IL-17A在肥胖代谢调控中的关键地位,也为其作为治疗靶点提供了临床前证据。抑制IL-17A信号可有效恢复脂肪细胞功能、促进产热、改善全身代谢稳态,从而在不依赖食欲抑制的情况下控制体重。这些发现支持进一步开发以IL-17A为靶点的抗肥胖疗法,例如已有抑制剂(如地高辛或RORγt拮抗剂)的再利用或新型药物的研发。
结语
该项研究系统阐释了IL-17A在饮食诱导肥胖及代谢紊乱中的核心作用,提出免疫代谢交叉调控的新视角。未来针对IL-17A信号轴的干预策略,有望为肥胖及相关代谢性疾病提供全新治疗选择,改善全球公共健康负担。













