- 最新进展
- 产品信息
- 参考文献
在免疫系统中,细胞的定向迁移是免疫应答发生的必要条件,而这一过程主要由趋化因子及其受体系统精确调控。作为G蛋白偶联受体(GPCR)超家族中的重要成员,趋化因子受体在炎症反应、免疫细胞归巢、组织发育及肿瘤微环境调控等生理和病理过程中发挥关键作用。其中,CCR5因其在HIV-1感染中作为共受体的角色而备受关注,同时也是治疗炎症性疾病和癌症的潜在靶点。尽管其病理重要性已被广泛认知,但CCR5在生理状态下如何识别内源性配体并转导信号的分子机制尚不明确,这一直是结构免疫学领域的重大挑战。

2021年7月,中国科学院上海药物研究所吴蓓丽、赵强、许叶春课题组在《自然-通讯》上发表了题为"Structural basis for chemokine recognition and receptor activation of chemokine receptor CCR5"的重要研究。该研究综合运用单颗粒冷冻电镜技术、X射线晶体学和分子动力学模拟等方法,成功解析了CCR5与内源性配体MIP-1α(CCL3)、RANTES(CCL5)及G蛋白复合物的高分辨率结构,首次系统揭示了CCR5的配体识别模式和信号转导机制。此项研究不仅解决了领域内长期存在的科学问题,也为靶向CCR5的药物设计提供了关键结构基础。
一、CCR5如何特异性“抓住”其内源性配体?
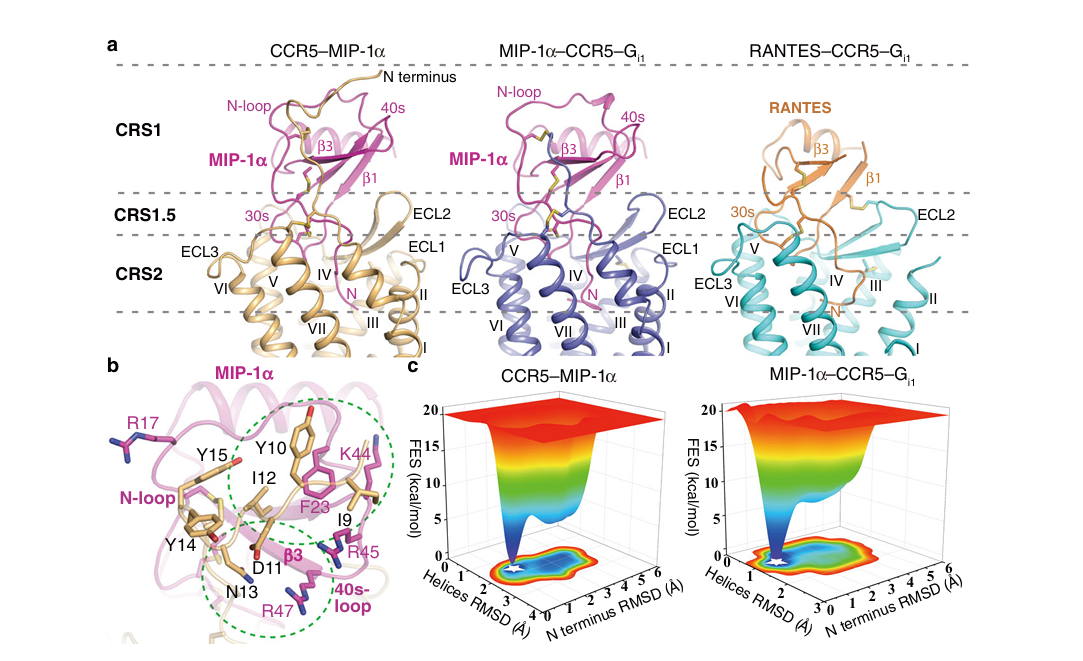
趋化因子受体对其配体的识别具有高度特异性。以往研究提示,受体胞外的N端结构域在这一过程中至关重要,但由于技术挑战,此前解析的所有趋化因子受体结构均未能包含完整的N端区域,使得精确的识别机制蒙上面纱。
本研究首先通过解析CCR5与其内源性配体MIP-1α(也称为CCL3)的高分辨率晶体结构,突破了这一瓶颈。该结构清晰地展示了CCR5完整的N端如何像一只“手”一样,与MIP-1α的核心区域发生精细的相互作用。通过结合二硫键交联实验和分子动力学模拟,研究人员首次精确描绘了N端与趋化因子相互作用的化学细节,阐明了配体特异性的结构基础。这不仅解答了长期以来的疑问,也为理解整个趋化因子受体家族的识别机制提供了关键范式。
二、面对不同配体,CCR5的结构如何灵活变通?
在生理状态下,一种趋化因子受体往往需要与多种配体相互作用。CCR5也不例外,其重要的内源性配体除MIP-1α外,还包括RANTES(即CCL5)。一个核心问题是:同一个受体如何适应不同配体的结构特征?
研究团队进一步解析了CCR5与RANTES及G蛋白结合的冷冻电镜结构,并将其与CCR5-MIP-1α-G蛋白的结构进行对比。他们发现了一个有趣的现象:与结合MIP-1α时相比,当CCR5与体积较大的RANTES结合时,其第一个和第二个跨膜螺旋会向外发生显著偏移,从而扩大配体结合口袋的开口,以容纳RANTES更具特色的N端片段。这一发现揭示了CCR5跨膜区具有固有的结构可塑性,这种构象上的灵活性是其能够高效结合不同内源性配体的结构基础,展现了生命分子设计的精妙与高效。

三、配体结合如何触发跨膜信号转导的“开关”?
G蛋白偶联受体(GPCR)激活的通用标志,是配体结合导致跨膜螺旋发生特定构象变化,进而将其胞内部分“打开”,招募并激活下游的G蛋白。对于CCR5而言,这个微观的“开关”具体是如何工作的?
通过比较激活态(与配体结合)与非激活态(与拮抗剂结合)的CCR5结构,研究揭示了其激活机制的关键步骤。无论是MIP-1α还是RANTES,它们的N端在结合后都会深插入CCR5的跨膜螺旋口袋中。这个插入动作如同按下开关,其关键作用是与跨膜螺旋上的重要氨基酸酪氨酸251形成氢键。该相互作用促使另一个关键色氨酸248的侧链构象发生翻转,并将其稳定在一个特定的、代表激活状态的位置上。W248构象的稳定,最终驱动了跨膜螺旋的集体重排,在胞内侧形成可与G蛋白结合的表面,从而成功启动信号转导。
四、不依赖配体,CCR5自身能否被激活?
除了配体依赖的激活,某些GPCR在无配体情况下也存在一定的本底(或称组成性)活性,这在生理和病理过程中可能具有意义。然而,趋化因子受体的组成性激活机制此前从未被阐明。
本研究的一个意外发现,来自于对不结合任何配体的CCR5与G蛋白复合物的结构分析。研究人员观察到,在无配体状态下,CCR5第二个跨膜螺旋上的色氨酸86侧链会发生90度翻转。这一翻转使得W86能够与Y108、Y251、W248等多个残基形成一个稳定的疏水相互作用网络。这个网络“意外地”将W248稳定在了与配体激活时相似的构象,从而驱使受体进入部分激活状态,并允许其与G蛋白结合。这是国际上首次在结构上阐明趋化因子受体的组成性激活机制,为理解该类受体的基础生物学开辟了新的方向。
结论与展望:从结构生物学到精准药物设计
该项研究通过对CCR5多种功能状态的结构解析,系统地描绘了其从配体识别到信号转导的全景分子图谱。它回答了关于配体特异性、结构灵活性、激活开关和组成性活性等多个核心科学问题,极大地深化了我们对趋化因子受体功能机制的理解。
更重要的是,这些高分辨率的结构信息为开发靶向CCR5的新一代药物奠定了坚实的基础。基于这些结构,科学家们可以更理性地设计针对艾滋病的高效、低耐药性抑制剂;也可以开发用于治疗多发性硬化症、风湿性关节炎等炎症性疾病的“偏向性配体”,以期在阻断致病信号的同时,保留其有益的生理功能。这项研究是基础科学研究面向人民生命健康、推动转化医学发展的典范,预示着靶向CCR5的精准药物研发即将进入一个全新的阶段。
Zhang, H., Chen, K., Tan, Q. et al. Structural basis for chemokine recognition and receptor activation of chemokine receptor CCR5. Nat Commun 12, 4151 (2021). https://doi.org/10.1038/s41467-021-24438-5













