- 最新进展
- 产品信息
什么是肿瘤免疫治疗及其核心机制?
肿瘤免疫治疗代表了一种革命性的癌症管理策略,其核心在于通过调动机体自身的免疫系统来识别、攻击并清除肿瘤细胞。与传统化疗或放疗直接杀伤细胞不同,免疫治疗旨在恢复或增强免疫系统对肿瘤的自然防御能力。该治疗的成功关键在于精准靶向肿瘤细胞表面特异性表达的分子,即肿瘤相关抗原(TAAs)。通过将宿主免疫系统(特别是T淋巴细胞)的杀伤导向这些TAAs,治疗旨在建立或重新激活针对癌细胞的强大且持久的适应性免疫反应。在过去几十年中,单克隆抗体(Mab)作为免疫治疗的重要武器取得了显著成就,大量靶向不同免疫检查点的单克隆抗体已获批准用于临床或处于晚期试验阶段。
4-1BB为何被视为一个有潜力的免疫治疗靶点?
4-1BB(亦称CD137或TNFRSF9)的发现可追溯至1989年,它最初被鉴定为在抗原刺激后T细胞上诱导表达的一个基因,而在静息T细胞上则不表达。进一步研究揭示,4-1BB的表达谱不仅限于活化的CD4+和CD8+ T淋巴细胞,还广泛存在于多种免疫细胞表面,包括树突状细胞(DCs)、自然杀伤细胞(NKs)、自然杀伤T细胞(NKTs)、嗜酸性粒细胞和肥大细胞。值得注意的是,具有免疫抑制功能的骨髓源性抑制细胞(MDSCs)通常不表达4-1BB。功能研究表明,通过激动型抗体靶向激活4-1BB信号,能够显著增强细胞毒性T细胞的活力和功能,并促进γ干扰素(IFN-γ)等关键细胞因子的产生,从而在临床前研究中展现出强大的抗肿瘤潜力,使其成为肿瘤免疫治疗领域备受关注的靶点之一。
4-1BB具有怎样的分子特性和信号传导机制?
要理解4-1BB的功能,需从其分子归属入手。4-1BB是肿瘤坏死因子受体超家族(TNFRSF)的29个成员之一,该家族在免疫调节中扮演核心角色。TNFRSF成员大致可分为两类:死亡受体和(如4-1BB所属的)激活受体。它们共同特征包括一个介导细胞内信号转导的胞内结构域和一个可与相应配体结合的胞外结构域。这些配体属于肿瘤坏死因子超家族(TNFSF)。研究表明,诸如CD40-CD40L、CD27-CD70、OX40-OX40L以及4-1BB-4-1BBL等TNFSF-TNFRSF配体-受体对,能够调控细胞发育、存活、死亡以及细胞因子和趋化因子的产生等关键生理过程。大量证据表明,该家族成员参与了包括癌症在内的多种疾病的炎症和病理过程,因此针对其相互作用的干预策略具有巨大的治疗潜力。
T细胞的完全活化需要双重信号。第一信号是抗原特异性的,由T细胞受体(TCR)识别抗原呈递细胞(APCs)表面MHC分子所呈递的抗原肽而产生。第二信号是非抗原特异性的共刺激信号,由T细胞和APCs表面的共刺激分子相互作用提供。4-1BB正是这样一种重要的共刺激分子,属于TNFRSF家族。其配体4-1BBL(属于TNFSF)于1994年被克隆,主要表达于活化的抗原呈递细胞如树突状细胞、B细胞和巨噬细胞上。
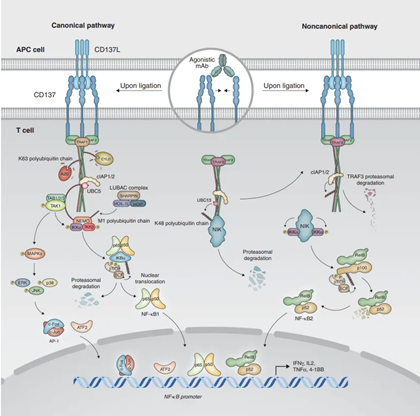
在分子机制上,4-1BB与其配体4-1BBL结合后,会募集TNFR相关因子(如TRAF1和TRAF2),进而激活下游的NF-κB、JNK/SAPK和p38 MAPK信号通路。这一系列信号事件为T细胞提供了强大的共刺激信号,尤其有利于促进CD8+细胞毒性T细胞的增殖和存活,并能通过提供存活信号来抑制活化诱导的细胞死亡(AICD),从而延长T细胞的效应功能。对于CD4+ T辅助细胞,p38 MAPK的激活对其向Th1或Th2亚群分化以及Th1效应细胞的功能调节至关重要。此外,4-1BB/4-1BBL通路的影响远不止于T细胞:它能放大单核细胞介导的恒定自然杀伤T细胞(iNKT)增殖,从而间接调控免疫应答;其激动剂可刺激脂肪细胞和巨噬细胞产生IL-6、TNF-α和MCP-1等炎症因子;在B细胞上,4-1BB的交联也能提供共刺激信号,激活并诱导B细胞增殖。
4-1BB激动剂抗体在临床前模型中如何发挥抗肿瘤作用?
大量动物实验证实,激动型抗4-1BB单克隆抗体能够在多种肿瘤模型中诱导并增强有效的抗肿瘤免疫。其作用机制复杂且多效,核心在于协调性地调节肿瘤微环境中的多种免疫细胞:
- 激活效应免疫细胞:抗4-1BB抗体能强烈刺激和激活关键的效应细胞。它能显著增强CD8+ T淋巴细胞的细胞毒活性和IFN-γ产生,激活NKT细胞和抗原呈递细胞(如巨噬细胞),从而协同杀伤癌细胞。同时,它能扩增肿瘤抗原特异性的记忆T细胞池并增强其功能,为实现长期免疫监视和防止复发奠定基础。研究还表明,4-1BB的共刺激信号可通过调节细胞周期蛋白及其依赖性激酶,并激活Akt通路,来促进T细胞周期进程和增殖。关于NK细胞的作用存在物种差异:在小鼠模型中,该抗体能明确激活NK细胞;而在人类系统中,其对NK细胞的影响(激活或抑制)可能更具情境依赖性。
- 抑制免疫抑制性细胞:在激活效应通路的同时,抗4-1BB抗体还能有效抑制免疫抑制细胞的活性和增殖。它能够抑制髓源性抑制细胞(MDSCs)和调节性T细胞(Tregs)在肿瘤部位的浸润和功能,从而解除肿瘤微环境的免疫抑制状态。有研究报道,其抑制Treg的作用部分可能与阻断IL-9的产生有关。
抗4-1BB抗体的这些效应高度依赖于4-1BB受体在靶细胞和宿主细胞上的表达。基因敲除研究表明,无论是肿瘤细胞还是宿主(包括造血和非造血来源细胞)上的4-1BB缺失,都会显著削弱甚至消除该抗体的抗肿瘤效果。特别值得注意的是,肿瘤相关内皮细胞表面表达的4-1BB有助于促进活化T细胞向肿瘤组织的迁移和浸润。此外,抗4-1BB抗体介导的肿瘤排斥(如淋巴瘤)需要穿孔素/颗粒酶和FAS-L这两种细胞溶解机制的协同作用。













