- 最新进展
- 产品信息
泛素-蛋白酶体系统

图1:泛素化及去泛素化系统
乳腺癌是女性患者经常确诊的癌症,占新诊断女性癌症的30%。研究表明泛素和泛素化在乳腺癌的发病和进展过程中发挥了重要作用。
泛素是一个76氨基酸的分子,相对分子质量为8.5kD。人类基因中有4种基因能编码泛素,分别为UBC、UBB、UBA52和UBA80。在ATP依赖的情况下,泛素通过E1-E3的酶联体系的作用与底物赖氨酸结合,从而对底物进行单泛素化、多重单泛素化、多聚泛素化。与泛素共价结合的蛋白能被蛋白酶体识别并降解,是细胞内短寿命蛋白和一些异常蛋白降解的普遍途径。
随着研究的进展,科学家们逐渐了解到泛素化和DUBs调节各种细胞活动,包括DNA修复、基因转录、细胞膜运输、细胞周期、应激反应、细胞分化、凋亡并影响癌症进展。
泛素化过程大致如下:
E1:泛素活化酶
E2:泛素结合酶
E3:泛素连接酶
首先,E1以ATP依赖的形式激活泛素C末端羧基,将泛素腺苷酰化,E1半胱氨酸残基与泛素的C端甘氨酸之间形成硫酯键。
然后活化的泛素被反式硫代到E2的半胱氨酸残基上形成新的硫酯键。
最后,E3连接酶通过底物的氨基协助或直接催化泛素从E2转移到底物。进而使靶蛋白特定赖氨酸残基的ε-氨基与泛素分子的C端的羧基形成异肽键,完成泛素化修饰。
泛素蛋白酶体系统(UPS)是维持细胞功能和稳定的关键调节器,超过80%的细胞内蛋白通过UPS进行降解。去泛素化酶(Deubiquitinating enzyme,DUBs)是UPS的组成部分,主要参与调节蛋白质泛素化和去泛素化的平衡状态。
DUBs可以解除底物蛋白与泛素的共价结合,逆转泛素化过程并回收利用再生的泛素分子。
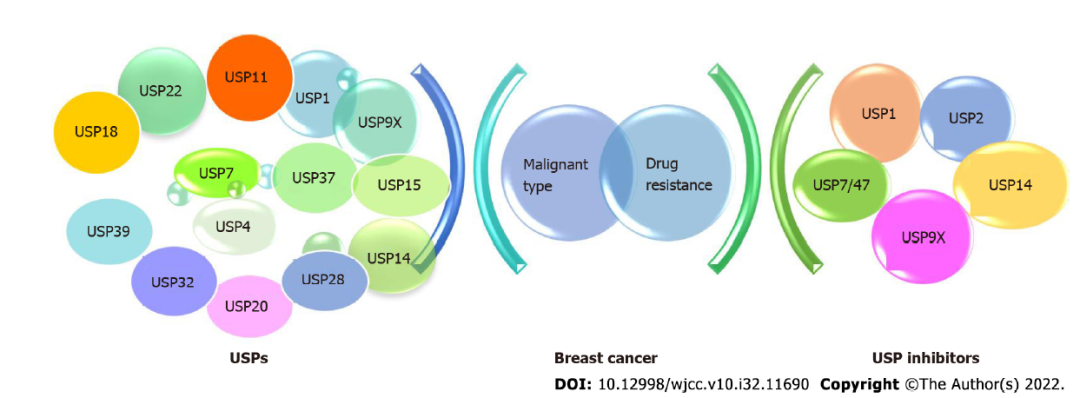
图2:不同去泛素化蛋白
基于活性部位的同源性,可以把DUBs分成6大家族。
USPs(unbiquitin-specific protease)属于半胱氨酸蛋白酶,在肿瘤或其微环境中异常表达,使其成为药物开发的靶点。大多数USP,包括USP1、USP4、USP7、USP9X、USP14、USP18、USP20、USP22、USP25、USP37和USP3都在肿瘤中过表达。
USP11
USP11在人体组织中分布广泛,其中视网膜的含量最高,是其他组织的5-10倍。人类USP11位于X染色体短臂1区1带3亚带,全长3300bp,包含22个外显子。USP11蛋白由963个氨基酸组成,在Hela细胞中USP11主要以921个氨基酸的形式存在。USP11主要定位在细胞核,在细胞质中也有少量分布。
介导蛋白的出核和入核
Ran-GTP是核蛋白出核和入核的一类必需蛋白质,同时涉及有丝分裂和减数分裂的纺锤体的形成。中心体蛋白RanBPM是Ran-GTP的结合蛋白,其对微管的正确成核是必需的,细胞内RanBPM蛋白发生损伤会使星状微管被破坏。研究者发现,USP11能够特异性结合到蛋白RanBPM的SPRY结构域上,并且剂量依赖地逆转已发生泛素化的RanBPM,防止其被泛素蛋白酶体降解。
DNA损伤修复
BRCA2属于抑癌基因,发生突变的个体易患乳腺癌、卵巢癌等。BRCA2能与其他肿瘤抑制蛋白包括相关蛋白BRCA1串联在一起,参与细胞周期损伤DNA修复等。研究表明USP11能特异性结合到BRCA2的C末端区域(2281-3418),通过对其去泛素化稳定BRCA2。实验表明细胞发生DNA损伤后,USP11在BRAC2蛋白存在的条件下可以促进细胞存活。
USP11调控信号转录
当细胞未被激活时,NF-κB二聚体与抑制蛋白ⅠκB结合,其核定位序列(NSL)被覆盖,NF-κB以无活性形式存在于细胞质中;当细胞受到TNF-alpha、白细胞介素等外界刺激时,NF-κB诱导激酶(NF-κB inducing Kinase,NIK)首先被活化,随后NIK激活ⅠκB激酶(ⅠκB Kinase, ⅠKK),活化的IKK对抑制蛋白IκB进行磷酸化修饰,促进ⅠκB泛素化降解,使NF-κB的NSL暴露出来,活化形式的NF-κB经核孔进入细胞核内,与特定的DNA序列(κB序列结合),从而调控特定基因的转录。研究表明USP11能对ⅠκBα进行去泛素化,通过稳定ⅠκBα而抑制TNF-alpha介导的NF-κB激活。 同时USP11可通过提高IKKα转录水平的表达,提升p53的表达从而调控p53下游基因的转录。
除此之外USP11还参与TGF-beta信号通路,细胞凋亡等过程。
与USP11相关疾病:脑瘤、乳腺癌、宫颈癌、流感、丙肝等。
USP7
USP7是泛素特异性蛋白酶家族的最重要成员之一。近年的研究表明USP7能调节细胞内众多蛋白的活性和功能,包括抑癌蛋白、DNA修复蛋白、免疫应答蛋白、病毒蛋白,表观遗传调节等,在疾病的发生发展中有着重要作用。
人USP7基因位于16号染色体短臂1区3带2亚带,全长4013bp,包含31个外显子。USP7蛋白含有1102个氨基酸残基,分子量135KDa,主要分布在细胞核、细胞质中也有少量分布。
USP7在哺乳动物中是一种非常保守的蛋白,人和小鼠以及大鼠的氨基酸序列有98.6%的一致性。USP7蛋白包含四个结构域:1个N末端(NTD),一个酶催化活性中心(aa208-560)和两个C末端蛋白酶抵抗结构域(CTD),NTD和CTD是USP7与其他蛋白结合的重要部位。
细胞存活
USP7与多种存活相关调控蛋白相关包括:DNMT1、RAE1、Bub3和Nup3。DNMT1( DNA methyltransferase 1,DNA甲基转移酶1)是人体内发现较早的甲基转移酶,在多种肿瘤中高表达。研究表明其与多种抑癌基因启动子区域CpG岛的过度甲基化有关。在体内,Dnmt1与USP7、UHRF形成三元复合物进而发挥作用。三元复合物中,USP7通过两个方面调控DNMT1,一是靶向并去泛素化DNMT1;二是直接刺激DNMT1的DNA甲基化活性。在体外USP7也能显著刺激DNMT1DNA甲基化活性的维持。
细胞周期调控
UHRF1(泛素样带有PHD和RING指环结构域1,也被称为Np95和ECBP90)通过结合半甲基化的CpG岛,并招募DNMT1在DNA复制过程中确保DNA甲基化的忠实传递。它的缺失与细胞周期G1期和G2/M期的失调有关。USP7能通过与UHRF1相互作用并介导其稳定性参与对细胞周期的调控。
染色质的重组
组蛋白由一个组蛋白八聚体(H2A、H2B、H3、H4)及围绕在其中的一段147bp的DNA构成。USP蛋白可以直接去泛素化组蛋白H2A参与细胞转录调控,同时,USP7还可以通过间接调控H2B的E3连接酶HDM2进一步调控H2B。研究发现,USP7可以在体外广泛去泛素化单泛素的H2B。
信号通路
USP7是第一个被确认的p53的底物特异性去泛素蛋白酶,USP7在体内和体外都能直接结合p53并去泛素化p53。过表达USP7能够稳定p53,促进p53依赖的凋亡和细胞生长停滞,抑制细胞的增殖。随后的研究发现,USP7不仅是p53的去泛素化酶,而且还能结合去泛素化的p53的负调控子HDM2。
结构和生化研究表明p53和HDM2相互排斥地竞争结合USP7的N端TRAF样的结构域中同一位点,但是USP7结合HDM2的亲和力明显高于p53数倍,这提示在正常细胞稳态的条件下,HDM2很可能是USP7优先结合的底物,而一旦发生DNA损伤,ATM介导HDM2发生磷酸化,降低它与USP7的亲和力,从而减弱它的稳定性。而在应激条件下,p53转变为USP7的主要底物,并被迅速稳定。
USP家族在肿瘤的发生和信号通路的调节中发挥重要作用,基于此,优爱重点开发USP家族蛋白包括:USP4、USP7、USP11、UAP13、USP14等,蛋白经活性验证,全速助力小分子药物研发!
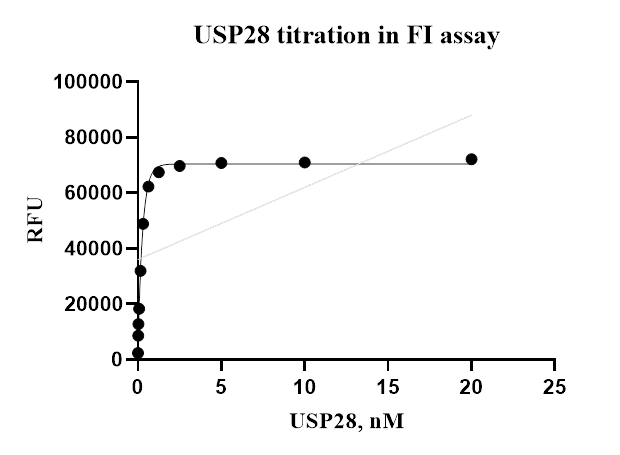
The USP28 activity was detected by cleaving the fluorogenic peptide substrate in FI assay. The reaction was performed by incubating the USP28 protein and substrate at 25℃ for 30 min, then reading RFU with BMG.
点击下方的产品货号,直达官网详情页供您了解













