- 最新进展
- 产品信息
- 参考文献
引言
多发性硬化症(MultipleSclerosis,MS)是一种典型的自身免疫性疾病,其病理机制尚不完全清楚。为了更深入地研究和理解MS的发病机制,科研人员广泛使用实验自身免疫性脑脊髓(EAE)动物模型。在这些模型中,MOG(髓鞘特异性糖蛋白)作为免疫原被用于诱导自身免疫性病变,模拟MS的发展过程。。
研究报道MOG是唯一既能引起脱髓鞘抗体反应又能引起T细胞反应的中枢神经系统髓鞘蛋白成分,因此用MOG作为免疫原诱导的EAE能更好地为MS/EAE发病机制的阐明提供研究材料。
MOG诱导EAE动物模型的建立
MOG是一种存在于髓鞘表面的糖蛋白,具有很高的免疫原性。将MOG作为抗原通过免疫途径引发免疫系统的应答,诱导EAE动物模型的建立。MOG的选择不仅源于其在髓鞘中的丰富表达,还因为它在多个物种中都能够有效地引起自身免疫性病变。
MOG诱导的EAE模型具有多个特点,包括快速发病、易于操作、复制性好等。这使得研究人员能够在控制的实验条件下,更好地模拟MS的免疫学和病理学特征,为疾病研究提供了有效的工具。
案例分享
工程化的MBP特异性人Tregs通过IL-2触发的效应T细胞抑制改善MOG诱导的EAE
为了进一步证明Ob2F3 Tregs在体内的旁观者抑制功能,在人HLA DR15转基因小鼠中采用MOG诱导的实验性变应性脑脊髓炎(EAE)作为MS的动物模型。用MOG主动免疫后第7天静脉注射人Ob2F3 Tregs,此时中枢神经系统炎症已经很好地建立起来。虽然这些细胞对小鼠宿主来说是异种的,但Ob2F3 Tregs显著降低了平均和累积疾病与PBS和17195 treg灌注小鼠相比,MOG诱导的EAE小鼠的评分(图A和B)。组织学分析证实,注射后2天,脑和脊髓中的Ob2F3 treg出现中枢神经系统迁移(图C);17195例Treg在同一天的迁移程度较低。重要的是,在注入Ob2F3 Ttreg的小鼠的两个组织中,hCD4-PE的强度明显高于非特异性17195 TCR Treg注入的小鼠(C)。在第17天,注入的Ob2F3或17195人Treg不再明显,可能是由于大脑或脊髓组织中的异种识别。此外,脊髓组织病理学分析显示,与17195或PBS组相比,Ob2F3治疗小鼠在第17天的炎症反应减轻,这与图A(图D)中观察到的EAE评分下降一致。为了确认输注的人Tregs可能积累,我们进一步用抗人CD4和抗小鼠CD4抗体对载玻片进行染色:血管周围细胞主要是小鼠CD4 T细胞(数据未显示)。从这些体内实验结果,我们得出结论,单克隆聚焦的MBP特异性Ob2F3 Tregs可以浸润到炎症的中枢神经系统组织中,并通过局部环境中的旁观者抑制机制改善MOG诱导的脑脊髓炎的发病机制。
Ob2F3 Tregs改善人源化HLADR15小鼠中MOG35-55诱导的EAE。使用pMOG35-55/CFA/PT主动诱导雄性和雌性HLADR15小鼠(4.5-7.5月龄)发生EAE。免疫后第7天,给小鼠静脉注射2×106工程化的MBP特异性Ob2F3人Tregs(Ob2F3)或对照17195人Tregs(17195,n=9)。另外一个对照组注射了PBS(n=5)。每天对EAE症状进行评分。显示了EAE的平均临床评分(A)和累积疾病指数(B)。数据来自两个具有相似结果的独立实验,并以平均值±SEM的形式呈现。通过Mann-WhitneyU检验分析两组之间的显着性。*p<0.05,Ob2F3组与PBS组;#p<0.05,Ob2F3组与17195组。(C)第9天注射的小鼠大脑水平冷冻切片中PE缀合的抗人CD4(红色)抗体的免疫荧光图像。细胞核用DAPI(蓝色)复染。原始放大倍数40倍,插图是在放大范围内重新拍摄的(右)。比例尺,10μm。右图显示了通过ZEN2012软件测量的放大图像的像素按升序排列的hCD4强度分布。(D)PBS、17195Treg和Ob2F3Treg注射小鼠的两个代表性H&E染色脊髓切片,在第9天注射,并在第17天收获。箭头表示血管周围脑区域。原始放大倍数20倍。比例尺,100μm。
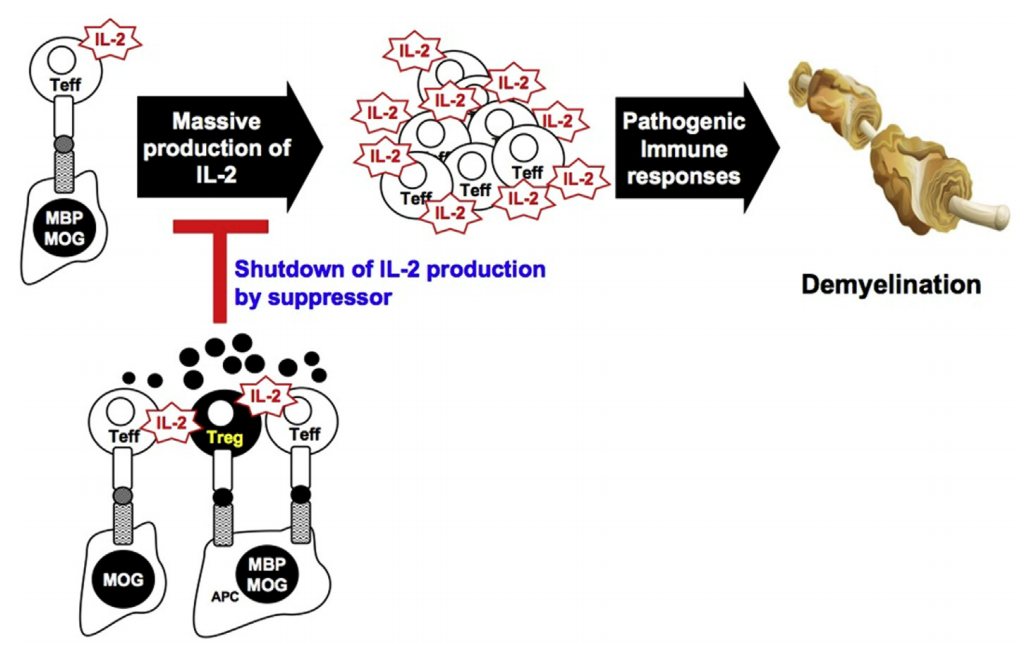
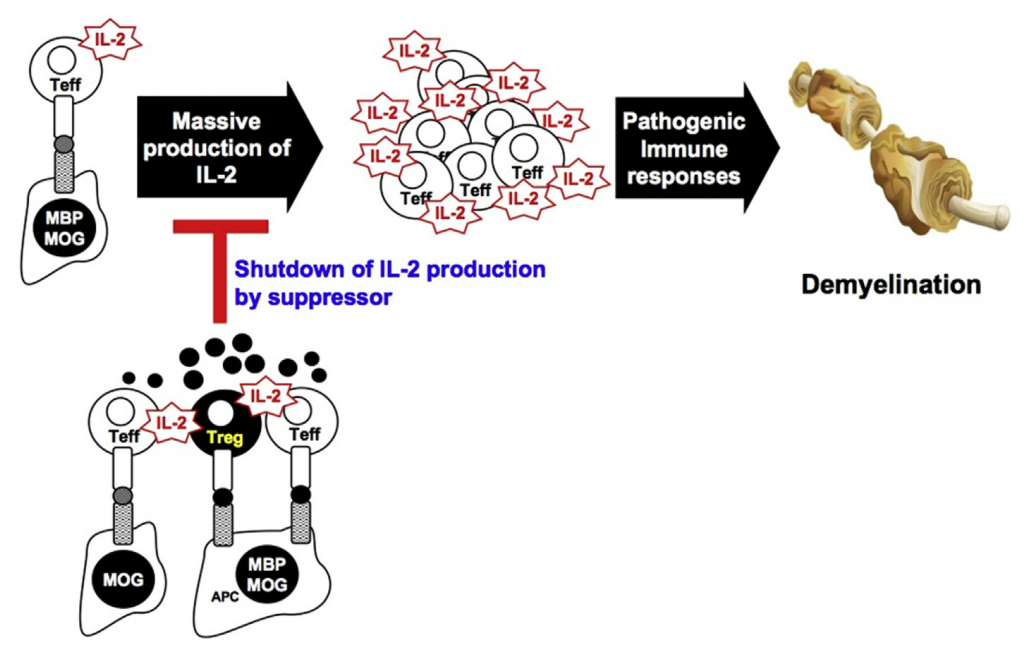
MBP特异性工程Tregs对MOG特异性效应T细胞的非接触抑制机制。MOG或MBP特异性T细胞克隆最初通过MOG产生IL-2或APC呈递MBP而被激活。效应细胞产生的IL-2在MOG或MBP特异性T效应器在淋巴结和炎症中枢神经系统中扩张期间提供强烈的次级信号,从而导致致病性脱髓鞘。通过输注MBP特异性单克隆Tregs,这些工程化Tregs在MBPp85-99肽和T效应器分泌的IL-2呈现时被激活,共享APC或在近端距离分开。激活的Tregs随后分泌可溶性抑制因子,从而在局部发炎环境中实现非接触式旁观者抑制,通过关闭Stat5(IL-2的关键下游信号通路)的磷酸化来抑制局部致病性T效应子的进一步增殖。
MOG诱导EAE动物模型在研究中的应用
1. 多发性硬化(MS)的病理生理研究:MOG诱导的EAE动物模型被广泛用于研究MS的发病机制、病理生理过程以及潜在的治疗方法。通过模拟MS的免疫学和神经病理学特征,研究者可以评估各种治疗策略的有效性。
2. 免疫调节疗法的研究:MOG-EAE模型可用于评估不同的免疫调节疗法,如免疫抑制剂、免疫调节剂和生物制剂等的效果。这些疗法可能有助于减轻疾病的严重程度或延缓病情进展。
3. 药物筛选和评估:研究人员可以利用MOG-EAE模型进行药物筛选和评估,以发现新的治疗方法或评估已有药物的疗效。这些药物可能包括免疫调节药物、神经保护剂和抗炎药物等。
4. 免疫细胞和信号通路的研究:MOG-EAE模型可以用来研究参与免疫反应的细胞类型(如T细胞、B细胞、巨噬细胞等)以及相关的信号通路。这有助于揭示MS和其他自身免疫性疾病的发病机制。
5. 神经保护策略的评估:除了免疫调节疗法外,MOG-EAE模型还可用于评估神经保护策略的有效性,如神经营养因子的应用、神经修复治疗等。
总结
MOG诱导的EAE动物模型为多发性硬化症的研究提供了重要的实验工具,促进了对该疾病发病机制的深入了解。然而,需要注意的是,任何动物模型都有其局限性,研究人员在使用该模型时应综合考虑其优点和缺陷,以更准确地解释实验结果。
1.Kim,Yong,Chan,etal.Engineered MBP-specifific human Tregs ameliorate MOG-induced EAE through IL-2-triggered inhibition of effffector T cells.JournalofAutoimmunity,2018.
2.KrishnamoorthyG.,LassmannH.,&WekerleH(2006).Experimentalmodelsofspontaneousautoimmunediseaseinthecentralnervoussystem.JournalofMolecularMedicine,84(5),416-428.
3.OliverA.R.,LyonG.M.,&RuddleN.H(2003).RatandhumanmyelinoligodendrocyteglycoproteinsinduceexperimentalautoimmuneencephalomyelitisbydifferentmechanismsinC57BL/6mice.JournalofImmunology,171(1),462-468.













