- 最新进展
- 产品信息
- 参考文献
在癌症免疫治疗领域,T细胞衔接器(T Cell Engager, TCE)已成为继免疫检查点抑制剂之后的又一革命性支柱。其核心在于巧妙地利用T细胞表面的CD3复合物,将其从基础免疫学概念转化为强大的治疗工具。
一、CD3:从信号枢纽到治疗靶标
CD3复合物(由γε、δε和ζζ二聚体组成)是T细胞受体(TCR)的信号传导模块。其胞内区的免疫受体酪氨酸激活基序是T细胞活化的"启动按钮"。这种与T细胞抗原特异性无关的、普适性的激活能力,使其成为TCE药物设计的理想锚定点。TCE分子通过双特异性结构,强制将T细胞(通过CD3)与肿瘤细胞(通过肿瘤相关抗原)拉近,形成免疫突触,从而绕过MHC限制,直接激活T细胞杀伤功能。
二、临床里程碑:已上市产品的演进与启示
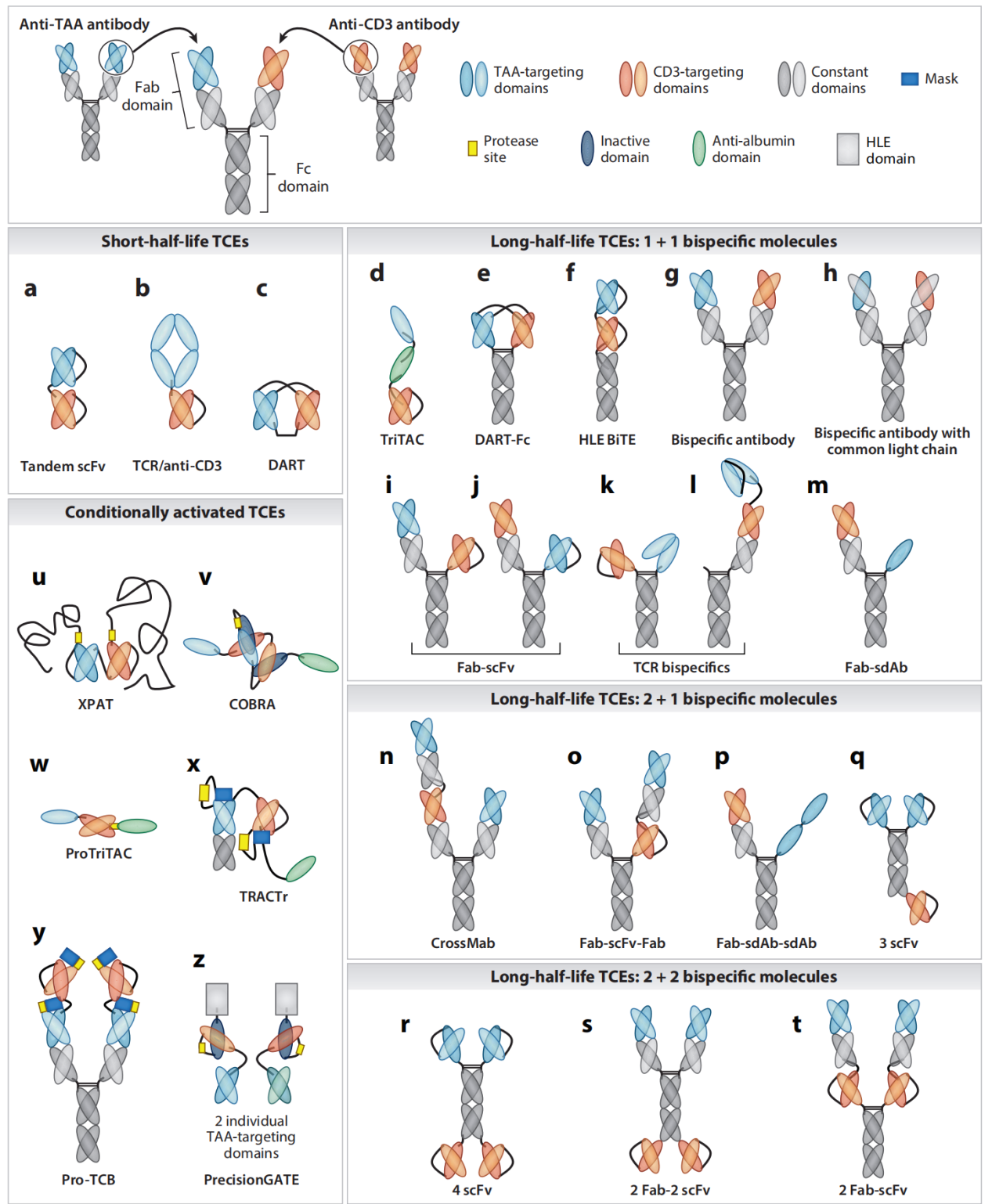
目前,全球已有十余款TCE药物获批上市,它们清晰地展现了该领域的发展轨迹:
1. 血液肿瘤的突破先锋:
Blinatumomab(Blincyto®):首款CD3双抗(靶向CD19),用于治疗复发/难治性B细胞急性淋巴细胞白血病。其短半衰期需持续静脉输注,但证明了TCE概念的临床可行性。
新一代血液瘤TCE:Teclistamab(靶向BCMA)、Talquetamab(靶向GPRC5D)、Elranatamab(靶向BCMA)等均已获批用于多发性骨髓瘤。它们采用皮下注射,便利性大幅提升,并优化了CD3亲和力以改善安全性。
2. 攻坚实体瘤的曙光:
Tebentafusp(Kimmtrak®):具有里程碑意义的首款实体瘤TCE(也是首款TCR样双特异性免疫疗法),用于治疗HLA-A02:01阳性、葡萄膜黑色素瘤。它一端靶向CD3,另一端使用TCR结构域靶向gp100肽-HLA复合物,为难以治疗的实体瘤开辟了新路。
Tarlatamab(Imdelltra®):2024年获FDA加速批准,用于治疗晚期小细胞肺癌(靶向DLL3)。其显著疗效证实了TCE在侵袭性实体瘤中的巨大潜力,成为行业关注的焦点。
三、前沿进展:创新策略应对核心挑战
为克服细胞因子释放综合征、神经毒性、靶点异质性与肿瘤微环境抑制等挑战,最新研究围绕CD3工程化展开了多维创新:
1. "亲和力 tuning" 2.0 与条件性激活:
在降低CD3端亲和力的基础上,新一代设计追求 "肿瘤微环境选择性激活" 。例如,设计pH敏感型或蛋白酶激活型TCE,使其仅在酸性的肿瘤微环境或被肿瘤特异性蛋白酶切割后才完全激活,最大限度地减少外周毒性。
逻辑门控TCE:开发三特异性或更复杂的分子,要求同时结合两个肿瘤抗原(如EGFR和c-MET)才能有效激活T细胞,极大提高了肿瘤靶向特异性,有望应用于抗原表达异质性的实体瘤。
2. 分子形式与功能拓展:
双抗-ADC偶联物:将TCE与抗体偶联药物结合,在重定向T细胞的同时,直接递送细胞毒性载荷,实现协同杀伤。
集成共刺激信号:在三特异性抗体中引入CD28或4-1BB的共刺激结构域,不仅激活T细胞,还提供第二信号,促进T细胞持久性和记忆形成,克服肿瘤微环境导致的T细胞耗竭。
通用型"模块化"TCE平台:设计一种固定CD3端的分子,其肿瘤靶向端可通过非共价键快速更换,实现针对不同靶点的快速管线开发。
3. 超越肿瘤:新兴治疗领域:
清除纤维化细胞:临床前研究显示,靶向成纤维细胞活化蛋白的TCE能有效逆转肺和肝纤维化。
靶向HIV潜伏库:设计同时结合CD3和HIV包膜蛋白的双特异性抗体,旨在清除病毒潜伏感染的细胞,实现功能性治愈。
结语
从血液肿瘤到实体瘤,从癌症到纤维化疾病,CD3靶向的TCE疗法正以前所未有的速度拓展其疆界。对CD3生物学的深刻理解与巧妙的蛋白质工程相结合,已催生出多款挽救生命的药物。未来,随着对T细胞激活逻辑的更精细解码和智能化分子设计的进步,下一代TCE药物将更加精准、安全与强大。CD3,这个T细胞上的古老"开关",正在人类智慧的编程下,指挥着免疫系统向最顽固的疾病发起一场精准而高效的革命。这场革命不仅重新定义了治疗模式,更深刻体现了从基础生物学到转化医学的非凡力量。
相关产品推荐:
| 货号 | 产品名称 |
|---|---|
| UA011360 | Biotinylated CD3E&CD3D Fc, His, Avi tag&Fc, Flag, Avi tag Protein, Human |
| UA011373 | CD3E&CD3D Heterodimer Llama Fc&Llama Fc Tag Protein, Human |
| UA010195 | CD3 delta His Tag Protein, Cynomolgus |
| UA010193 | CD3 delta His Tag Protein, Human |
| UA010173 | CD3 epsilon Fc Chimera Protein, Cynomolgus |
| UA010199 | CD3 epsilon Fc Chimera Protein, Human |
| UA010598 | CD3 gamma Fc Chimera Protein, Human |
- Tara Arvedson; Julie M. Bailis; Carolyn D. Britten; Matthias Klinger; Dirk Nagorsen; et al. Targeting Solid Tumors with Bispecific T Cell Engager Immune Therapy.Annual Review of Cancer Biology.2021.
- Yingtang Zhou; Ming‐Guo Liu; Fei Ren; Xiangjiao Meng; Jinming Yu.The landscape of bispecific T cell engager in cancer treatment.Biomarker Research.2021.